
【题目】(1)室温下,在0.5mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·(OH-)___(填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4) =1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.008mol/LK2CrO4溶液, 则溶液中的c(CrO42-)=___。
(3)室温下,0.1mol/LNaHCO3溶液的pH值___0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=")。
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
已知:
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe.则该电池在充电时,阳极发生反应的物质是___,放电时负极反应式为___。
【答案】变小 1.19×10-10 mol/L < Na2S,Fe Na-e-=Na+
【解析】
(1)主要考虑纯碱溶液中加入少量水后,由水电离出的c (OH-)变小,据此回答;
(2)溶液混合,发生反应2Ag++CrO4 2-=Ag2CrO4,求出剩余的银离子浓度,再通过Ksp(Ag2CrO4) =1.0×10-12,按公式计算c(CrO42-)=![]() ;
;
(3)要判断室温下0.1mol/LNaHCO3溶液和0.1mol/LNa2SO3溶液的pH值大小,就是先要判断碳酸氢钠溶液是呈碱性的,再要判断![]() 和
和![]() 的水解能力,水解能力大,溶液碱性相对较强;
的水解能力,水解能力大,溶液碱性相对较强;
(4)充电时阳极反应是放电时正极反应的逆反应,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,可据此找到充电时,阳极发生反应的物质,要写放电时负极反应式,可按Na+总量不变找到负极的氧化反应就是钠失去电子的反应;
(1)室温下,在0.5mol/L的纯碱溶液中加入少量水,促进碳酸钠水解,![]() 增加,但是由于加水溶液被稀释,由水电离出的c (OH-)变小,因为由水电离出的c(H+)与c(OH-)相等,所以由水电离出来的c(H+)·c(OH-)变小;
增加,但是由于加水溶液被稀释,由水电离出的c (OH-)变小,因为由水电离出的c(H+)与c(OH-)相等,所以由水电离出来的c(H+)·c(OH-)变小;
答案为:变小;
(2)设两溶液体积均为V,0.2mol/L的AgNO3溶液与等体积的0.008mol/LK2CrO4溶液混合以后,发生反应2Ag++CrO4 2-=Ag2CrO4,反应后n(Ag+)=(0.2mol/L·V-2×0.008mol/L·V)=0.184 mol/L·V,则反应后多余的银离子浓度为c(Ag+)=![]() ,已知Ksp(Ag2CrO4) =1.0×10-12,则c(CrO42-)=
,已知Ksp(Ag2CrO4) =1.0×10-12,则c(CrO42-)=![]() mol/L=1.19×10-10 mol/L;
mol/L=1.19×10-10 mol/L;
答案为:1.19×10-10 mol/L;
(3)![]() 水解反应方程式为:
水解反应方程式为:![]() ,
,![]() 的水解常数为
的水解常数为![]() ,则
,则![]() >5.6×10-11,所以
>5.6×10-11,所以![]() 的水解程度大于其电离程度,碳酸氢钠溶液呈碱性,因为K1(H2CO3)>K2(H2SO3),则
的水解程度大于其电离程度,碳酸氢钠溶液呈碱性,因为K1(H2CO3)>K2(H2SO3),则![]() 的水解能力小于
的水解能力小于![]() 的水解能力,
的水解能力,![]() 溶液的碱性小于
溶液的碱性小于![]() 的溶液的碱性;
的溶液的碱性;
答案为: <;
(4)因为是可充电电池Na—Al/FeS,充电时阳极反应是放电时正极反应的逆反应,因为正极反应式为2Na++FeS+2e-=Na2S+Fe,所以该电池在充电时,阳极反应为Na2S+Fe-2e-=2Na++FeS,则发生反应的物质为Na2S,Fe;
答案为:Na2S,Fe;
因为电池工作时Na+的物质的量保持不变,原电池工作时正极为正极反应式为2Na++FeS+2e-=Na2S+Fe,并且是用含Na+的导电固体作为电解质,可知负极反应为Na-e-=Na+;
答案为:Na-e-=Na+。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】立方烷(![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点。下面是立方烷衍生物Ⅰ的一种合成路线:
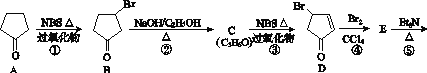
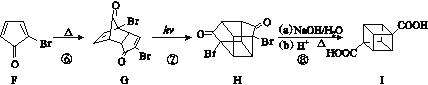
回答下列问题:
(1)C的结构简式为______________,E的结构简式为______________。
(2)③的反应类型为______________,⑤的反应类型为______________。
(3)化合物A可由环戊烷经三步反应合成:
![]()
反应1的试剂与条件为________;反应2的化学方程式为_______________;反应3可用的试剂为________。
(4)在合成I物质的路线中,互为同分异构体的化合物是________(填化合物代号)。
(5)立方烷经硝化可得到六硝基立方烷,其可能的结构有________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
A.6.4gB.3.2gC.1.6gD.0.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
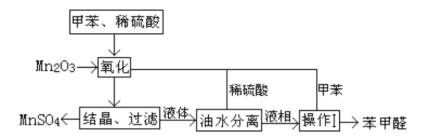
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。
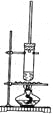
下列对该实验的描述错误的是
A.不能用水浴加热
B.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
C.长玻璃管起冷凝回流作用
D.加入过量乙酸可以提高1-丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等方面。下图是从含碘CCl4溶液得到碘的实验过程:
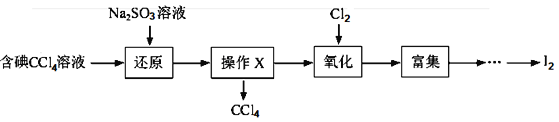
完成下列填空:
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为_________;该操作将I2还原为I-的目的是__________。
(2)操作X的名称为_______,所用的主要仪器是_________。
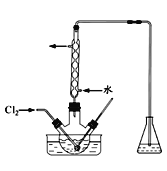
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_________;锥形瓶里盛放的溶液为________。
(4)已知:5SO32-+2IO3-+2H+ → I2+5SO42-+H2O某含碘溶液(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘溶液中是否同时含有I-、IO3-的实验方案:_______。实验中可供选择的试剂:CCl4、稀盐酸、淀粉溶液
(5)浓海水提取镁的工艺流程如下图:
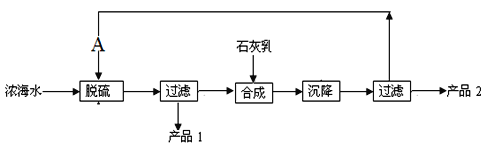
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为________,产品2的化学式为__________。1L浓海水最多可得到产品2的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应mA(g)+nB(g)![]() qC(g),△H在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断正确的是
qC(g),△H在密闭容器中进行。如图表示在不同时刻t、温度T和压强p下B物质在混合气体中的体积分数φ(B)的变化情况。下列推断正确的是

A. p1>p2,T1<T2,m+n>q,△H<0
B. p1<p2,T1>T2,m+n>q,△H>0
C. p1>p2,T1<T2,m+n<q,△H<0
D. p1<p2,T1>T2,m+n<q,△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛:
己知:H2CO3:Kal=4.3×l0-7 ,Ka2=5.6×l0-ll HC1O,Ka=2.98×l0-8
(1)室温下,0.l mol/L的次氯酸钠溶液和0.l mol/L的碳酸氢钠溶液,碱性较强的是___________;其原因是___________。
(2)己知新制氯水中存在三种分子和四种离子。在500mL l mol.L-l的碳酸钠溶液中,通入11.2L(标准状况)的Cl2,充分反应以后,溶液中离子浓度在前三位的大小顺序为__________;
(3)BrF3具有较强的氧化性,可以和许多还原剂反应。在一定条件下,BrF3和H2O反应生成O2和等物质的量的Br2和HBrO3,写出该反应的化学方程式_____________;
(4)向CuCl2溶液中滴加NaOH溶液,有蓝色沉淀生成,继续滴加一定量的NaHS溶液后,生成CuS黑色沉淀,用溶解平衡和电离平衡原理解释上述现象__________________;
(5)将1.12L(标准状况)CH3F在纯氧中完全燃烧,将产物通入足量的澄清石灰水中,溶液中有白色固体生成,白色沉淀是_____________、_________,再通入过量的CO2沉淀部分消失,继续滴加浓盐酸浊液变澄清,用离子方程式解释上述现象__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图1所示(加热、搅拌和仪器固定装置均已略去):实验过程如下:
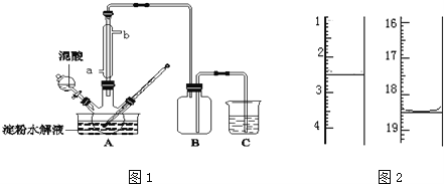
①将1:1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO4的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体,硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:_________;
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是_________;
(3)检验淀粉是否水解完全所用的试剂为_________;
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有_________;
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸.用KMnO4标准溶液滴定,该反应的离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O称取该样品0.12g,加适量水完全溶解,然后用0.020molL﹣1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为_________,滴定前后滴定管中的液面读数如图2所示,则该草酸晶体样品中二水合草酸的质量分数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com