
【题目】元素周期表中第VIIA族元素的单质及其化合物的用途广泛:
己知:H2CO3:Kal=4.3×l0-7 ,Ka2=5.6×l0-ll HC1O,Ka=2.98×l0-8
(1)室温下,0.l mol/L的次氯酸钠溶液和0.l mol/L的碳酸氢钠溶液,碱性较强的是___________;其原因是___________。
(2)己知新制氯水中存在三种分子和四种离子。在500mL l mol.L-l的碳酸钠溶液中,通入11.2L(标准状况)的Cl2,充分反应以后,溶液中离子浓度在前三位的大小顺序为__________;
(3)BrF3具有较强的氧化性,可以和许多还原剂反应。在一定条件下,BrF3和H2O反应生成O2和等物质的量的Br2和HBrO3,写出该反应的化学方程式_____________;
(4)向CuCl2溶液中滴加NaOH溶液,有蓝色沉淀生成,继续滴加一定量的NaHS溶液后,生成CuS黑色沉淀,用溶解平衡和电离平衡原理解释上述现象__________________;
(5)将1.12L(标准状况)CH3F在纯氧中完全燃烧,将产物通入足量的澄清石灰水中,溶液中有白色固体生成,白色沉淀是_____________、_________,再通入过量的CO2沉淀部分消失,继续滴加浓盐酸浊液变澄清,用离子方程式解释上述现象__________________。
【答案】NaCIO 由电离常数可以判断出碳酸酸性大于次氯酸的酸性,所以同浓度的NaCl0溶液的水解程度大,碱性强 c(Na+)>c(Cl-)>c(HCO3-) 3BrF3+5H2O=O2↑+Br2+HBrO3+9HF Cu(OH)2(s)![]() Cu2++2OH-,加入NaHS溶液后,HS-
Cu2++2OH-,加入NaHS溶液后,HS-![]() H++S2-,由于CuS的溶解度极小,所以Cu2+ + S2- = CuS↓,所以有生成CuS黑色沉淀 CaF2 CaCO3 CaCO3+CO2+H2O=Ca2++2HCO3-;CaF2+2H+=Ca2++2HF
H++S2-,由于CuS的溶解度极小,所以Cu2+ + S2- = CuS↓,所以有生成CuS黑色沉淀 CaF2 CaCO3 CaCO3+CO2+H2O=Ca2++2HCO3-;CaF2+2H+=Ca2++2HF
【解析】
(1)电离常数越大,酸性越强,其对应的盐的水解程度越小,碱性越弱,H2CO3的电离常数大于HClO,则酸性HClO小于碳酸,所以碳酸氢钠的水解程度小于次氯酸钠,水解程度越大,碱性越强,则次氯酸钠的碱性强;
(2)在500mL、1mol/L的碳酸钠溶液中,通入11.2L(标准状况)的Cl2,二者的物质的量均为0.5mol,碳酸钠与氯气等物质的量反应生成NaCl、碳酸氢钠和次氯酸,其反应的方程式为Na2CO3+Cl2+H2O=NaHCO3+NaCl+HClO,HCO3-离子在溶液中发生水解,其浓度减小,则c(Na+)>c(Cl-)>c(HCO3-);
(3)BrF3和H2O反应生成O2、HF、Br2和HBrO3,根据电子守恒、原子守恒规律,该反应的化学方程式为3BrF3+5H2O=O2↑+Br2+HBrO3+9HF;
(4)向CuCl2溶液中滴加NaOH溶液,有蓝色Cu(OH)2沉淀生成,混合物中存在沉淀溶解平衡:Cu(OH)2(s)![]() Cu2++2OH-,加入NaHS溶液后,HS-
Cu2++2OH-,加入NaHS溶液后,HS-![]() H++S2-,由于CuS的溶解度极小,所以Cu2++S2-=CuS↓,所以有生成CuS黑色沉淀;
H++S2-,由于CuS的溶解度极小,所以Cu2++S2-=CuS↓,所以有生成CuS黑色沉淀;
(5)CH3F在纯氧中完全燃烧生成HF、CO2和水,HF、CO2与氢氧化钙反应生成氟化钙沉淀和碳酸钙沉淀,过量的CO2与碳酸钙反应生成碳酸氢钙,发生反应CaCO3+CO2+H2O=Ca2++2HCO3-,沉淀部分溶解;由于盐酸的酸性大于氢氟酸,继续加盐酸后,氟化钙转化为氟化氢,发生CaF2+2H+=Ca2++2HF,最终沉淀全部溶解,形成溶液。


科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)室温下,在0.5mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·(OH-)___(填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4) =1.0×10-12,向0.2mol/L的AgNO3溶液中加入等体积的0.008mol/LK2CrO4溶液, 则溶液中的c(CrO42-)=___。
(3)室温下,0.1mol/LNaHCO3溶液的pH值___0.1mol/LNa2SO3溶液的pH值(填“>”、“<”、“=")。
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
已知:
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含Na+的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe.则该电池在充电时,阳极发生反应的物质是___,放电时负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图装置(夹持装置略,气密性已检验)某同学用含有铁锈(Fe2O3)的废铁屑来制取氯化铁晶体,下列推断不合理的是
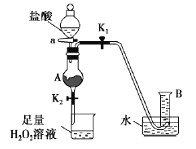
A.B中收集到的气体是氢气
B.烧杯中双氧水溶液作用是将Fe2+还原为Fe3+
C.A中的氧化铁与盐酸反应生成氯化铁
D.烧杯中溶液在氯化氢气氛下,蒸发浓缩、冷却结晶、过滤后得到氯化铁晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g) ![]() 2NH3(g)+Q ,若反应过程中n(H2)和n(NH3)随时间变化的关系如下图所示,则下列有关叙述中一定正确的是
2NH3(g)+Q ,若反应过程中n(H2)和n(NH3)随时间变化的关系如下图所示,则下列有关叙述中一定正确的是
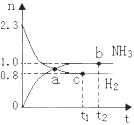
A.若在t2时刻再充入一定量He,达平衡时C(H2)< 0.4mol/L
B.a点表示NH3生成速率与NH3分解速率相等
C.b点和c点H2的转化率相等
D.若在t1时刻再充入一定量H2,达平衡时化学平衡常数变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Heck反应是偶联反应的一种,例如:反应①如下:
![]() +CH3OOCCH=CH2(Ⅰ)
+CH3OOCCH=CH2(Ⅰ)![]()
![]() (Ⅱ)
(Ⅱ)
化合物I可以由以下途径合成:
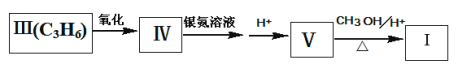
回答以下问题:
(1)化合物Ⅱ的分子式为_____,1mol该物质最多可与________molH2发生加成反应。
(2)卤代烃CH3CHBrCH3发生消去反应可以生成化合物Ⅲ,相应的化学方程式为: ________(注明条件)。
(3)分子式为C4H6O的化合物Ⅵ,满足以下条件:①与化合物IV互为同系物;②含有甲基且无支链,写出其结构简式________。
(4)一定条件下,![]() 与
与 ![]() 也可以发生类似反应①的反应,其有机产物的结构简式为__________。
也可以发生类似反应①的反应,其有机产物的结构简式为__________。
(5)设计一条以CH3CHClCHClCH3和![]() 为原料合成
为原料合成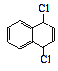 的路线_______。
的路线_______。
提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:(用合成路线流程图表示为:A![]() B……
B……![]() 目标产物)。
目标产物)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语,应用正确的是 ( )
A.硝基苯的结构简式是:![]()
B.乙炔的电子式是:![]()
C.乙醚分子的球棍模型是: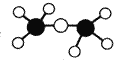
D.甲酸中存在一CHO和—COOH两种官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有三份不同质量的硫化铜与硫化亚铜的混合物样品①②③。甲、乙、丙三同学各取一种样品,加强热充分反应,测定各样品中硫化铜的量。
(1)甲取2.56克样品①,置于空气中加强热,产物为氧化铜和二氧化硫。若产生0.448 L气体(标准状况),该气体被30 mL一定浓度氢氧化钠恰好完全吸收,将所得溶液小心低温蒸干得固体2.3克。则样品①中硫化铜的质量为_____g,氢氧化钠浓度_______mol·L-1;
(2)乙取3.52克样品②,投入过量的浓硝酸中加热,充分反应后,样品全部参与反应,溶液失重8.44克。样品②中硫化铜的物质的量为____mol;若浓硝酸的浓度为14.2 mol·L-1,则反应消耗浓硝酸____mL。(已知:Cu2S+14HNO3→2Cu(NO3)2+10NO2↑+H2SO4+6H2O)
(3)丙称量样品③强热后剩余的固体质量比原样品减小了a g,若该固体为氧化铜,则样品③中硫化铜物质的量(n)为_________mol。若要计算硫化亚铜的质量,则缺少_____________数据,若设该数据为b克,则硫化亚铜的质量为___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com