
����Ŀ�������ݲ�ͬ��������ͭ������ͭ�Ļ������Ʒ�٢ڢۡ��ס��ҡ�����ͬѧ��ȡһ����Ʒ����ǿ�ȳ�ַ�Ӧ���ⶨ����Ʒ����ͭ������
(1)��ȡ2.56����Ʒ�٣����ڿ����м�ǿ�ȣ�����Ϊ����ͭ�Ͷ�������������0.448 L���壨��״�����������屻30 mLһ��Ũ����������ǡ����ȫ���գ���������ҺС�ĵ������ɵù���2.3�ˡ�����Ʒ������ͭ������Ϊ_____g����������Ũ��_______mol��L-1��
(2)��ȡ3.52����Ʒ�ڣ�Ͷ�������Ũ�����м��ȣ���ַ�Ӧ����Ʒȫ�����뷴Ӧ����Һʧ��8.44�ˡ���Ʒ������ͭ�����ʵ���Ϊ____mol����Ũ�����Ũ��Ϊ14.2 mol��L-1����Ӧ����Ũ����____mL��(��֪��Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O)
(3)��������Ʒ��ǿ�Ⱥ�ʣ��Ĺ���������ԭ��Ʒ��С��a g�����ù���Ϊ����ͭ������Ʒ������ͭ���ʵ���(n)Ϊ_________mol����Ҫ��������ͭ����������ȱ��_____________���ݣ����������Ϊb�ˣ�������ͭ������Ϊ___________��
���𰸡�0.96 1 0.02 23.9 0.0625a��![]() ��Ʒ������ b-6a ��
��Ʒ������ b-6a ��
��������
(1)����n=![]() ����SO2�����ʵ�����Ȼ������Sԭ���غ㡢������������CuS��������������ԭ���غ㡢�õ���������������������ơ��������Ƶ����ʵ������ٸ�����ԭ���غ�����������Ƶ����ʵ���Ũ�ȣ�
����SO2�����ʵ�����Ȼ������Sԭ���غ㡢������������CuS��������������ԭ���غ㡢�õ���������������������ơ��������Ƶ����ʵ������ٸ�����ԭ���غ�����������Ƶ����ʵ���Ũ�ȣ�
(2)CuS��Cu2S�����ᷢ����Ӧ��CuS+10HNO3=Cu(NO3)2+8NO2��+H2SO4+4H2O��Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O�����ݹ�����������Һʧ�������з���ʽ����CuS�����ʵ���������CuS��Cu2S������Ĺ�ϵʽ��������������
(3)CuS��Cu2S������Ӧ����CuO�����ݻ�ѧʽ֪��Cu2S����Է��������൱��2��CuO����Է������������Է�Ӧ�����м��ٵ������൱��CuS---CuO֮����ٵ��������ݴ˼���CuS�����ʵ�����Ҫ��������ͭ������������Ҫ֪����Ʒ�ܵ�����������m=n��M����CuS����������������ȥCuS��������������ͭ��������
(1) n(SO2)=![]() =
=![]() =0.02 mol����CuS�����ʵ���Ϊx mol��Cu2S�����ʵ���Ϊy mol����x+y=0.02��96x+160y=2.56�����x=0.01��y=0.01����m(CuS)=0.01 mol��96 g/mol=0.96 g���跴Ӧ����Na2SO3�����ʵ���Ϊa mol��NaHSO3�����ʵ���Ϊb mol��a+b=0.02��126a+104y=2.3�����a=0.01��b=0.01�����Ը�����ԭ���غ��n(NaOH)=2n(Na2SO3)+n(NaHSO3)=2��0.01 mol+0.01 mol=0.03 mol����NaOH��Һ�����ʵ���Ũ��c(NaOH)=
=0.02 mol����CuS�����ʵ���Ϊx mol��Cu2S�����ʵ���Ϊy mol����x+y=0.02��96x+160y=2.56�����x=0.01��y=0.01����m(CuS)=0.01 mol��96 g/mol=0.96 g���跴Ӧ����Na2SO3�����ʵ���Ϊa mol��NaHSO3�����ʵ���Ϊb mol��a+b=0.02��126a+104y=2.3�����a=0.01��b=0.01�����Ը�����ԭ���غ��n(NaOH)=2n(Na2SO3)+n(NaHSO3)=2��0.01 mol+0.01 mol=0.03 mol����NaOH��Һ�����ʵ���Ũ��c(NaOH)=![]() =1 mol/L��
=1 mol/L��
(2)��CuS�����ʵ���Ϊc mol��Cu2S�����ʵ���Ϊd mol������ݹ���������Ϊ3.52 g�ɵã�96c+160d=3.52������CuS��Cu2S�����ᷢ����Ӧ��CuS+10HNO3=Cu(NO3)2+8NO2��+H2SO4+4H2O��Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O����Һʧ�ؿɵã�272c+300d=8.44����ʽ���������c=0.02 mol��d=0.01 mol��������Ʒ����CuS�����ʵ���Ϊ0.02 mol��Cu2SΪ0.01 mol����CuS+10HNO3=Cu(NO3)2+8NO2��+H2SO4+4H2O��֪��0.02 molCuS��ȫ��Ӧ��Ҫ��������ʵ���n(HNO3)=0.02mol��10=0.2 mol������Cu2S+14HNO3��2Cu(NO3)2+10NO2��+H2SO4+6H2O��֪��0.01 mol Cu2S��ȫ��Ӧ��Ҫ��������ʵ���n(HNO3)=0.01 mol��14=0.14 mol������Ҫ�ܵ���������ʵ���n(HNO3)��=0.2 mol+0.14 mol=0.34 mol�����Ҫ��������V(HNO3)��=![]() =0.0239 L=23.9 mL��
=0.0239 L=23.9 mL��
(3)CuS��Cu2S������Ӧ����CuO�����ݻ�ѧʽ֪��Cu2S����Է��������൱��2��CuO����Է������������Է�Ӧ�����м��ٵ������൱��CuS---CuO֮����ٵ�����������n(CuS)=![]() mol=0.0625a mol��m(CuS)=96 g/mol��
mol=0.0625a mol��m(CuS)=96 g/mol��![]() mol=6a g������m(Cu2S)=bg-6a g=(b-6a) g��
mol=6a g������m(Cu2S)=bg-6a g=(b-6a) g��


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�����ڱ��е�VIIA��Ԫ�صĵ��ʼ��仯�������;�㷺��
��֪��H2CO3:Kal=4.3��l0-7 ��Ka2=5.6��l0-ll HC1O��Ka=2.98��l0-8
��1�������£�0.l mol/L�Ĵ���������Һ��0.l mol/L��̼��������Һ�����Խ�ǿ����___________����ԭ����___________��
��2����֪������ˮ�д������ַ��Ӻ��������ӡ���500mL l mol.L-l��̼������Һ�У�ͨ��11.2L(��״��)��Cl2����ַ�Ӧ�Ժ���Һ������Ũ����ǰ��λ�Ĵ�С˳��Ϊ__________��
��3��BrF3���н�ǿ�������ԣ����Ժ����ԭ����Ӧ����һ�������£�BrF3��H2O��Ӧ����O2�͵����ʵ�����Br2��HBrO3��д���÷�Ӧ�Ļ�ѧ����ʽ_____________��
��4����CuCl2��Һ�еμ�NaOH��Һ������ɫ�������ɣ������μ�һ������NaHS��Һ������CuS��ɫ���������ܽ�ƽ��͵���ƽ��ԭ��������������__________________��
��5����1.12L(��״��)CH3F�ڴ�������ȫȼ�գ�������ͨ�������ij���ʯ��ˮ�У���Һ���а�ɫ�������ɣ���ɫ������_____________��_________����ͨ�������CO2����������ʧ�������μ�Ũ������Һ����壬�����ӷ���ʽ������������__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��IJ��C6H12O6�����������������Ʊ����ᣬװ����ͼ1��ʾ�����ȡ�����������̶�װ�þ�����ȥ����ʵ��������£�
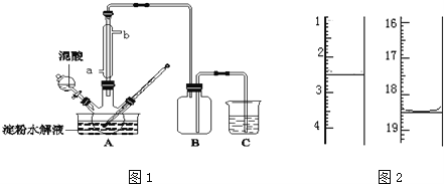
�ٽ�1��1�ĵ���ˮ��Һ���������ᣨ98%�������ձ��У�ˮԡ������85�桫90��������30min��Ȼ�����¶Ƚ���60�����ң�
�ڽ�һ�����ĵ���ˮ��Һ����������ƿ�У�
�ۿ��Ʒ�ӦҺ�¶���55��60�������£��߽�������μ�һ�����������������Ļ��ᣨ65%HNO3��98%H2SO4��������Ϊ2��1.5����Һ��
�ܷ�Ӧ3h���ң���ȴ����ѹ���˺����ؽᾧ�ò��ᾧ�壬������������ˮ��Һ�����пɷ������з�Ӧ��
C6H12O6+12HNO3��3H2C2O4+9NO2��+3NO��+9H2O
C6H12O6+8HNO3��6CO2+8NO��+10H2O
3H2C2O4+2HNO3��6CO2+2NO��+4H2O
��ش��������⣺
��1��ʵ��ټ���98%���������������ǣ�_________��
��2��ʵ����������μӹ��죬�����²�������½�����ԭ����_________��
��3����������Ƿ�ˮ����ȫ���õ��Լ�Ϊ_________��
��4�������ؽᾧ�ļ�ѹ���˲����У����ձ����������⣬������ʹ�����ڹ����β��ϵ�������_________��
��5������Ʒ�ں�������Լ90�����º�������أ��õ���ˮ�ϲ��ᣮ��KMnO4����Һ�ζ����÷�Ӧ�����ӷ���ʽΪ��2MnO4��+5H2C2O4+6H+=2Mn2++10CO2��+8H2O��ȡ����Ʒ0.12g��������ˮ��ȫ�ܽ⣬Ȼ����0.020molL��1������KMnO4��Һ�ζ����յ㣨���ʲ����뷴Ӧ������ʱ��Һ��ɫ�仯Ϊ_________���ζ�ǰ��ζ����е�Һ�������ͼ2��ʾ����ò��ᾧ����Ʒ�ж�ˮ�ϲ������������Ϊ_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����17.6��Fe2O3��Cu�Ļ�����ܽ���������ϡ�����У��ټ�����9.8�ˣ��������ܽ����Һ����Fe3+���˹��̹�����2.24��H2(���)���������ж���ȷ����
A.�������Cuȫ��������ΪCu2+�Ժ�Cu2+��ȫ������ԭ
B.�������Cuȫ��������ΪCu2+�Ժ�Cu2+�ֲ��ֱ���ԭ
C.�������Cu���ֱ�����ΪCu2+�Ժ�Cu2+��ȫ������ԭ
D.�������Cu���ֱ�����ΪCu2+�Ժ�Cu2+�ֲ��ֱ���ԭ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��һ�廷����(![]() )��NaOH�Ĵ���Һ���ȷ�������ˮ�ⷴӦ������ȥ��Ӧ���ס��ҡ�����λͬѧ�ֱ������������ʵ�鷽����
)��NaOH�Ĵ���Һ���ȷ�������ˮ�ⷴӦ������ȥ��Ӧ���ס��ҡ�����λͬѧ�ֱ������������ʵ�鷽����
�ף���Ӧ���Һ�е���ϡ�����к�NaOH��Ȼ���ٵ���AgNO3��Һ������dz��ɫ�����������֤����������ȥ��Ӧ��
�ң���Ӧ���Һ�е�����ˮ������Һ��ɫ�ܿ���ȥ�����֤����������ȥ��Ӧ��
������Ӧ���Һ�е�������KMnO4��Һ������Һ��ɫ��dz�����֤����������ȥ��Ӧ��
������ȷ���ǣ� ��
A. �� B. �� C. �� D. ����ʵ�鷽��������ȷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�ͭ����(CuCl2��2H2O)�к���FeCl2���ʣ�Ϊ�Ƶô������Ȼ�ͭ���壬���Ƚ����Ƴ�ˮ��Һ���ٰ���ͼ��ʾ�IJ�����������ᴿ��
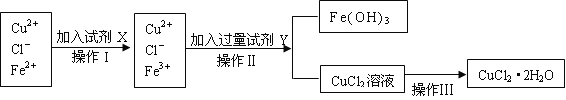
������±�������������ա�
�������↑ʼ����ʱ��pH | �������������ȫʱ��pH | |
Cu2�� | 4.7 | 6.7 |
Fe2�� | 7.0 | 9.0 |
Fe3�� | 1.9 | 3.7 |
(1)����I����X��Ŀ����_________________��
(2)�������ʶ�������ΪX���ʺϱ�ʵ���X���ʿ�����(��ѡ��)_________ ��
A��KMnO4 B��NaClO C��H2O2 D��Cl2
(3)����II��Y�Լ�Ϊ____________(�ѧʽ)����������Һ��pH��______��Χ��
(4)ʵ����������CuCl2��Һʱ���������_________(����������)��������(�������������й����ӷ���ʽ��ʾ)_________________ __________��
(5)����CuCl2��Һ�������գ��õ��Ĺ�����_________________(�ѧʽ)����Ҫ����ˮCuCl2���������������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ɴ�����Ⱦ����Ҫ�к�����֮һ����ҵ�Ʊ�����ĽӴ����ж�����������ȫת��Ϊ��������β�����봦����ij��ȤС��ģ��Ӵ����з�Ӧ����ͼ�Ƿֱ������ֲ�ͬʵ�������½��з�Ӧ����Ӧ����������Ũ����ʱ��ı仯��
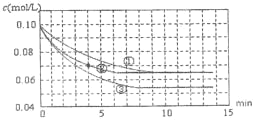
(1)��ҵ������ĽӴ������ö��������������������������������Ϊ_______��
(2)ʵ��ڣ�0��4min ƽ����Ӧ����v(O2)=______��
(3)ʵ��ۿ��ܸı��������ʲô��______��������ɡ�______����֪����Ӧ���ȣ�
(4)��������β�������ð�ˮ���գ����յIJ��������(NH4)2SO4��(NH4)2SO3��NH4HSO3�������ߵ����ʵ���Ũ����ͬʱ��笠�����Ũ���ɴ�С��˳��Ϊ______��
(5)Ũ�����dz����ĸ����������Ͳ��ܸ��������백����ԭ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º��ݵ��ܱ������а����±��ס��ҡ������ַ�ʽ�ֱ�Ͷ�ϣ�������Ӧ��3H2��g����N2��g�� ![]() 2NH3��g������ü�������H2��ƽ��ת����Ϊ 40%������˵����ȷ���ǣ� ��.
2NH3��g������ü�������H2��ƽ��ת����Ϊ 40%������˵����ȷ���ǣ� ��.
N2��mol�� | H2��mol�� | NH3��mol�� | |
�� | 1 | 3 | 0 |
�� | 0.5 | 1.5 | 1 |
�� | 0 | 0 | 4 |
A.�������з�Ӧ���������
B.�ﵽƽ��ʱ���ס��ҡ�����������NH3��������Ĵ�С˳�ף���>��
C.���е�NH3ת����Ϊ40%
D.�����ں��º�ѹ���ܱ��������У�ƽ������������ٳ���4 mol NH3�����´ﵽƽ��ʱ����ϵ��NH3�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����~����Ԫ�������ڱ��е����λ��������������ԭ���������3�����һ�ֵ�������Ȼ��Ӳ���������ʣ���������ͬ����Ԫ�أ������ж���ȷ����
A.�������ԭ���������3
B.��̬�⻯������ȶ��ԣ���>��>��
C.����������Ԫ���У�������ӵİ뾶���
D.�����¼ĵ�����ˮ�з�ӦҪ���Ҿ��Һܶ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com