
【题目】在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)![]() H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
A.加入H2O(g),平衡向正反应方向移动,体系压强减小
B.加入CO,混合气体的密度增大
C.降低温度,平衡向正反应方向移动
D.加入少量C,正反应速率增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】CuSO4 5H2O是铜的重要化合物,有着广泛的应用。
(一)CuSO4·5H2O制取
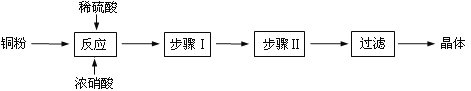
完成下列填空:
(1)向含铜粉的稀硫酸中滴加少量浓硝酸(可加热),铜粉溶解时可以观察到的实验现象:_____。
(2)根据反应原理,硝酸与硫酸的理论配比(物质的量之比)为______________________。
(3)步骤Ⅰ______________;步骤Ⅱ______________。
(二)胆矾中CuSO4·5H2O含量的测定
已知:CuSO4 + 2NaOH → Cu(OH)2 ↓+ Na2SO4
(1)实验方案如下,并将步骤④补全:
①将12.500g胆矾样品溶解,配成100mL溶液,取25mL于烧杯中;
②向溶液中加入100mL0.2500mol/L氢氧化钠溶液使Cu2+完全沉淀(不考虑其它副反应);
③过滤,多余的氢氧化钠溶液用0.5000mol/L盐酸滴定至终点,耗用10.00mL盐酸;
④___________________________
⑤数据处理。
(2)在滴定中,眼睛应注视__________;滴定终点时,准确读数应该是滴定管上________所对应的刻度。
(3)就方案中数据进行处理,则样品CuSO4·5H2O中质量分数为___________。步骤③中沉淀未洗涤,导致结果______(填偏大、偏小、无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L恒容密闭容器中充入1mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
PCl3(g)+Cl2(g)反应过程中测定的部分数据见表(反应过程中条件不变);
t/s | 0 | 60 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
请回答下列问题:
(1)x的值是___。
(2)0~60s内,用PCl3的浓度变化表示的化学反应速率是__。
(3)60s时,PCl5的转化率是__。
(4)达平衡时,容器中Cl2的体积分数是__(结果保留一位小数),由表中数据计算此条件下,该反应的平衡常数是__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO、NO2是常见的氧化物。用H2或CO催化还原NO可达到消除污染的目的。
已知:2NO(g)=N2(g)+O2(g) △H= -180.5 kJmol1,2H2O(l)=2H2(g)+O2(g) △H=+571.6 kJmol1。
(1)则用H2催化还原NO消除污染的热化学方程式是_______________。
(2)苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是:C8H10 (g)![]() C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
C8H8(g)+H2(g) △H=+120 kJmol1,某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内气体物质的量,得到数据如表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.24 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.20 | 0.20 |
①当反应进行到20min时,该段时间内H2的平均反应速率是__________。
②该温度下,该反应的化学平衡常数是__________。
③若保持其他条件不变,用0.4molH2(g)和0.4molC8H8(g)合成C8H10(g),当有12kJ热量放出时,该反应中H2的转化率是______.此时,该合成反应是否达到了平衡状态?______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g)![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A.NO与O2的物质的量的比值不再改变B.混合气体的颜色不再改变
C.容器体积不再改变D.混合气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,密闭容器中进行反应CH4(g) + H2O(g) ![]() CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是
CO(g) + 3H2(g),测得CH4的体积百分含量随温度和压强的变化如图所示。下列说法正确的是

A. p1>p2
B. ΔH<0
C. 加入催化剂可以提高甲烷的转化率
D. 恒温下,缩小容器体积,平衡后CH4浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.1L 1 mol·L-1的CH3COOH溶液中含有氢离子数约为6.02×1023
B.18g D2O(重水)完全电解,转移的电子数约为6.02×1023
C.34 g H2O2中含有的阴离子数为约为6.02×1023
D.STP下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,将2 mol A和2 mol B气体投入固定容积为2 L的密闭容器中发生反应:2A(g)+B(g)![]() xC(g)+D(s),10 s时,测得A的物质的量为1.7 mol,0~10 s内C的反应速率为0.0225 mol·L-1·s-1;40 s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10 s时,测得A的物质的量为1.7 mol,0~10 s内C的反应速率为0.0225 mol·L-1·s-1;40 s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=________;
(2)平衡时容器中B的体积分数为________;
(3)该温度下此反应的平衡常数表达式为_____________,数值是__________;
(4)下列各项能表示该反应达到平衡状态的是________________________;
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在绝热恒容2L密闭容器中进行反应:N2(g)+3H2(g) ![]() 2NH3(g)+Q ,若反应过程中n(H2)和n(NH3)随时间变化的关系如下图所示,则下列有关叙述中一定正确的是
2NH3(g)+Q ,若反应过程中n(H2)和n(NH3)随时间变化的关系如下图所示,则下列有关叙述中一定正确的是
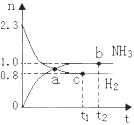
A.若在t2时刻再充入一定量He,达平衡时C(H2)< 0.4mol/L
B.a点表示NH3生成速率与NH3分解速率相等
C.b点和c点H2的转化率相等
D.若在t1时刻再充入一定量H2,达平衡时化学平衡常数变小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com