
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g)![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A.NO与O2的物质的量的比值不再改变B.混合气体的颜色不再改变
C.容器体积不再改变D.混合气体的密度不再改变
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过以下反应制得:2NO(g)+Cl2(g)![]() 2ClNO(g)。按投料比[n(NO):n(Cl2)]=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率 与温度T、压强p(总压)的关系如图所示:
2ClNO(g)。按投料比[n(NO):n(Cl2)]=2:1把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率 与温度T、压强p(总压)的关系如图所示:
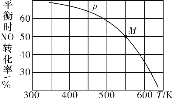
(1)该反应的△H____(填“>”“<”或“=”)0。
(2)在压强为p条件下,M点时容器内NO的体积分数为_______。
(3)若反应一直保持在p=b Pa压强条件下进行,则M点的分压平衡常数Kp=________(用含b的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
(4)实验测得,v正=k正·c2(NO)·c(Cl2),v逆=k逆·c2(ClNO)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数____(填“>”“<”或“=”)k逆增大的倍数。
②若在2 L的密闭容器中充入1 mol Cl2和1 mol NO,在一定温度下达到平衡时,NO的转化率为40%,则k正:k逆=________。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是
A.该合金中含有铝的质量至少为5.4 g
B.合金中镁的质量分数为63.3%≤Mg%<100%
C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2
D.在产生沉淀后的溶液中有1.5 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol冰醋酸和1mol乙醇经催化加热反应可生成H2O分子数为NA
B.常温常压下,将15g NO和8g O2混合,所得混合气体分子总数小于0.5NA
C.标准状况下,2.24 L的CCl4中含有的C—Cl键数为0.4NA
D.6.8g熔融态KHSO4中含有0.1NA个阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中对应关系正确的是( )
A | CH3CH3+Cl2 CH2=CH2+HCl→CH3CH2Cl | 均为取代反应 |
B | 由油脂得到甘油;由卤代烃制醇 | 均发生了水解反应 |
C | Cl2+2Br→2Cl+Br2;Zn+Cu2+→Zn2++Cu | 均为单质被还原的置换反应 |
D | 2Na2O2+2H2O→4NaOH+O2↑; 2F2+2H2O→4HF+ O2 | 均为水作还原剂的氧化还原反应 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行如下反应:H2O(g)+C(s)![]() H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
H2(g)+CO(g) △H>0, 达到平衡后,改变下列反应条件,相关叙述正确的是 ( )
A.加入H2O(g),平衡向正反应方向移动,体系压强减小
B.加入CO,混合气体的密度增大
C.降低温度,平衡向正反应方向移动
D.加入少量C,正反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的短周期部分。
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有 _____ 种不同伸展方向的电子云,最外层共有 _____ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)_______>__________;b、c 两元素非金属性较强的是(写元素符号)________,写出证明这一结论的一个化学方程式 ___________________ 。
(3)d、e元素形成的四原子化合物的电子式为___________;b、g元素形成的分子bg2为__________分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd 4)2和盐S:ca4agd4 ,相同条件下,0.1 mol/L 盐R中c(ca4+)________(填“等于”、“大于”或“小于”)0.1 mol/L 盐S中c(ca4+)。
(5)向盛有10mL1 mol/L盐S溶液的烧杯中滴加1 mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是 __________________________________________ 。
(6)向盛有10mL 1 mol/L盐 R溶液的烧杯中滴加1 mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL—35mL)间发生的离子方程式: _________________________ 。若在10mL 1 mol/L 盐R溶液的烧杯中加20mL1.2 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
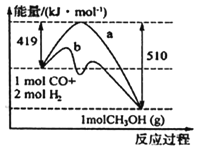
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
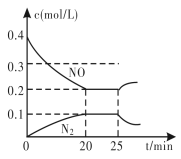
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.1000mol/LNaOH溶液滴定20.00mL、0.0100mol/LHCl溶液所得到的滴定曲线
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c < a < b
D.图Ⅳ表示反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com