
����Ŀ��Ϊ�˲ⶨijþ���Ͻ�ijɷ֣�ȡ14.7 g�Ͻ���ȫ����500 mL 3 mol/L�������У��ټ���400 mL 8 mol/L������������Һ��ַ�Ӧ�����ֻ����һ�ֳ���������ڸúϽ�IJⶨ���̵�������ȷ����
A.�úϽ��к���������������Ϊ5.4 g
B.�Ͻ���þ����������Ϊ63.3%��Mg%<100%
C.�ڲ������������Һ��һ������0.2 mol NaAlO2
D.�ڲ������������Һ����1.5 mol Na2SO4
���𰸡�BD
��������
14.7gþ���Ͻ���ȫ����500mL 3mol/L�������У��ټ���400mL 8mol/L������������Һ��Ӧ����Һ�еij��������ӣ�����٣���þ������ǡ�ó�����������þ����������ʱ����Һ��ֻ����Na2SO4����ʱn(Na+)=2n(SO42)����Ϊ��n(Na+)=n(NaOH)��n(SO42)=n(H2SO4)������n(NaOH)=2n(H2SO4),�������ɵij��������ʱ��n(NaOH)=2n(H2SO4)=2��3mol/L��0.5L=3mol��������400mL 8mol/L������������Һ��ַ�Ӧֻ����һ�ֳ�����֤�����������Ѿ�������������ȫ��Ӧ��������������Ϊ��0.4L��8mol/L=3.2mol���ܽ���������������������Ϊ��3.2mol3mol=0.2mol
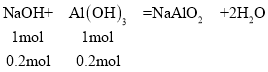
�����������������Ϊ0.2mol����ԭ���غ�֪��n(Al)=n[Al(OH)3]=0.2mol��m(Al)=0.2mol��27g/mol=5.4g��m(Mg)=14.7gm(Al)=14.75.4g=9.3g��
A�����Ϸ���֪���úϽ��к���������������Ϊ5.4g����A����
B�����Ϸ���֪���úϽ��������������Ϊ5.4g��þ������Ӧ����9.3g14.7g֮��(����9.3g)��![]() ��100%Mg%��
��100%Mg%��![]() ��100%����63.3%Mg%��100%����B��ȷ��
��100%����63.3%Mg%��100%����B��ȷ��
C�����Ϸ���֪���úϽ��к���������������Ϊ0.2mol���ڲ������������Һ����ຬ��0.2mol NaAlO2����C����
D���ڲ������������Һ����Na2SO4��NaAlO2������ԭ���غ�֪��n(Na2SO4)=n(H2SO4)=3mol/L��0.5L=1.5mol����D��ȷ��
��ѡBD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮú����CO ��H2�����ϳɼ״�����Ҫԭ�ϣ�������ˮ����ͨ�����ȵ�̿���Ƶã�C(s)+H2O(g)![]() CO(g)+H2(g) ��H=+131.3kJ/mol
CO(g)+H2(g) ��H=+131.3kJ/mol
���÷�Ӧ��ƽ�ⳣ���ı���ʽΪ��_________________�������¶ȣ�Kֵ�� �������������ƽ����Է��������� ��������������������С����������������
��������Ӧ�ﵽƽ�����ϵ�е�C(s)�������ߣ�ƽ���� ������ţ���
A�������� B�������� C�����ƶ�
��������ʵ��˵���÷�Ӧ��һ���������Ѵﵽƽ��״̬���� ������ţ���
A����λ�����ÿ����1molCO��ͬʱ����1molH2
B��������������ʵ������ֲ���
C������H2O(g)������������CO���������
D��H2O(g)��CO��H2��Ũ�����
��������Ӧ��t0ʱ�̴ﵽƽ�⣨��ͼ��������t1ʱ�̸ı�ijһ����������ͼ�м�������t1ʱ�̺�c(CO)��ʱ��ı仯���ߣ�
����С�����������ʵ�߱�ʾ����
�ڽ����¶ȣ������߱�ʾ����
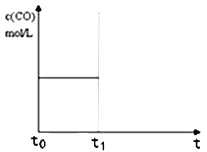
��ij�¶��£���4.0mol H2O(g)��������̿����2L���ܱ������У��������·�Ӧ��C(s)+H2O(g)![]() CO(g)+H2(g)���ﵽƽ��ʱ���K=1������¶���H2O(g)��ת����Ϊ ��
CO(g)+H2(g)���ﵽƽ��ʱ���K=1������¶���H2O(g)��ת����Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() �����ԭ������Ϊ34.969���������˵����ȷ����( )
�����ԭ������Ϊ34.969���������˵����ȷ����( )
A.��Ԫ�صĽ������ԭ������Ϊ35
B.��Ԫ�ص�ij��ͬλ�ص�������Ϊ35
C.��Ԫ�ص�������Ϊ18
D.��ԭ�ӵ�����Ϊ34.969
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Է�ĩ״���ڣ��Ͱ�������������ͬ�������塣��֪��
��Sn��s���ף�+2HCl��aq��=SnCl2��aq��+H2��g�� ��H1
��Sn��s���ң�+2HCl��aq��=SnCl2��aq��+H2��g�� ��H2
��Sn��s���ң�![]() Sn��s���ף� ��H3=+2.1kJmol-1
Sn��s���ף� ��H3=+2.1kJmol-1
����˵����ȷ���ǣ� ��
A.��H1>��H2
B.���ڳ������Ի���״̬����
C.����תΪ�����ķ�Ӧ�Ƿ��ȷ�Ӧ
D.���������ڴ��ڵ���13.2��Ļ����У������лٻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼������ѧ����Ԫ�أ��䵥�ʼ��������ж��ص����ʺ���;���ش����⣺
��1����̬̼ԭ�ӵĵ����Ų�ͼΪ___��CO2����___���ӣ�ѡ����ԡ��Ǽ��ԡ�����
��2��60��SiO2�����к��е�Si-O����ĿΪ___����NA��ʾ����
��3���л���M�� ����̼���ӻ�������__������ԭ��֮�������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ__��
����̼���ӻ�������__������ԭ��֮�������Ԫ��ԭ�ӵĵ�һ�������ɴ�С��˳��Ϊ__��
��4��̼Ԫ�����γɶ��ֵ�������ʯ��ʯī��C60�ȣ��ش��������⣺
����C60�ľ���������__���塣
����ʯī��һ�ֻ�Ͼ��ͣ��ṹ�о��е���������___��
a.���ۼ� b.���Ӽ������� c.��� d.������ e.���Ӽ�
�����ʯ�����ṹ��ͼ��ʾ��������ʯ�����ı߳�Ϊa cm������٤������ΪNA������ʯ���ܶȿ��Ա�ʾΪ___g/cm3��
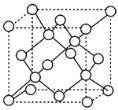
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���2L�����ܱ������г���1mol PCl5��������Ӧ��PCl5(g)![]() PCl3(g)+Cl2(g)��Ӧ�����вⶨ�IJ������ݼ�������Ӧ�������������䣩��
PCl3(g)+Cl2(g)��Ӧ�����вⶨ�IJ������ݼ�������Ӧ�������������䣩��
t/s | 0 | 60 | 150 | 250 | 350 | 450 |
n(PCl3)/mol | 0 | 0.12 | 0.19 | 0.2 | 0.2 | x |
��ش��������⣺
��1��x��ֵ��___��
��2��0~60s�ڣ���PCl3��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������__��
��3��60sʱ��PCl5��ת������__��
��4����ƽ��ʱ��������Cl2�����������__���������һλС�������ɱ������ݼ���������£��÷�Ӧ��ƽ�ⳣ����__mol��L-1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������װ��˵����ȷ����( )
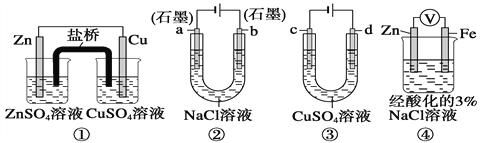
A. װ�â��У������е�K+����ZnSO4��Һ
B. װ�âڹ���һ��ʱ���a��������Һ��pH����
C. ��װ�â۾���ͭʱ����Һ��Cu2+��Ũ��һ��ʼ�ղ���
D. װ�â��е�����Zn����Fe��װ������Fe2+����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������º�ѹ�����г���2 mol NO��1 mol O2��������Ӧ��2NO(g)+O2(g)![]() 2NO2(g)�������������˵����Ӧ�Ѵﵽƽ��״̬����(�� ��)
2NO2(g)�������������˵����Ӧ�Ѵﵽƽ��״̬����(�� ��)
A.NO��O2�����ʵ����ı�ֵ���ٸı�B.����������ɫ���ٸı�
C.����������ٸı�D.���������ܶȲ��ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪������A(C5H8)��֧����ֻ��һ�������š��л�������A~H��ת����ϵ������ʾ��
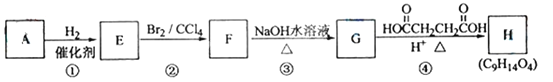
��ش��������⣺
(1)A�Ľṹ��ʽ��_________________��������________________��
(2)����B��A�IJ�ͬ����ͬ���칹�壬B�����⻯ת��Ϊ�����飬д��B���п��ܵĽṹ��ʽ_________________________________________________________��
(3)д����Ӧ���ͣ���Ӧ��___________________����Ӧ��____________________��
(4)д����Ӧ�ܵĻ�ѧ����ʽ��_____________________________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com