
【题目】已知:链烃A(C5H8)有支链且只有一个官能团。有机化合物A~H的转换关系如下所示:
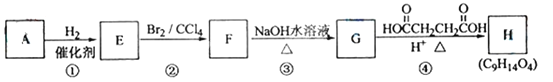
请回答下列问题:
(1)A的结构简式是_________________,名称是________________。
(2)链烃B是A的不同类别的同分异构体,B经催化氢化转化为正戊烷,写出B所有可能的结构简式_________________________________________________________。
(3)写出反应类型:反应②___________________,反应③____________________。
(4)写出反应④的化学方程式:_____________________________________________。
【答案】CH![]() C-CH(CH3)2 3-甲基-1-丁炔 CH3CH=CHCH=CH2 CH2=CHCH2CH=CH2 加成反应 水解反应(取代反应)
C-CH(CH3)2 3-甲基-1-丁炔 CH3CH=CHCH=CH2 CH2=CHCH2CH=CH2 加成反应 水解反应(取代反应) 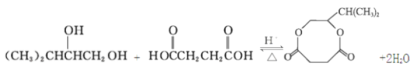
【解析】
链烃A(C5H8)有支链且只有一个官能团,根据结构式推断符合规律![]() ,则A是炔烃;反应①是加成反应;反E能与溴的四氯化碳溶液继续反应生成F,则E是烯烃:3-甲基-1-丁烯;F的结构简式是:
,则A是炔烃;反应①是加成反应;反E能与溴的四氯化碳溶液继续反应生成F,则E是烯烃:3-甲基-1-丁烯;F的结构简式是:![]() ,F到G是卤代烃的水解反应,生成醇。
,F到G是卤代烃的水解反应,生成醇。
(1) 链烃A(C5H8)有支链且只有一个官能团,且是炔烃,则A的结构简式是CH![]() C-CH(CH3)2,名称是3-甲基-1-丁炔;
C-CH(CH3)2,名称是3-甲基-1-丁炔;
(2) 链烃B是A的不同类别的同分异构体,B经是含两个碳碳双键的烯烃,又两个双键在同一个碳上不稳定,又B经催化氢化转化为正戊烷,则B可能的结构简式:CH3CH=CHCH=CH2 、CH2=CHCH2CH=CH2;
(3)由分析知,反应②是加成反应;反应③卤代烃的水解反应;
(4)反应④的化学方程式: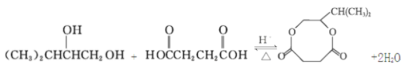 。
。


科目:高中化学 来源: 题型:
【题目】为了测定某镁铝合金的成分,取14.7 g合金完全溶于500 mL 3 mol/L的硫酸中,再加入400 mL 8 mol/L的氢氧化钠溶液充分反应,最后只产生一种沉淀。则关于该合金的测定过程的描述正确的是
A.该合金中含有铝的质量至少为5.4 g
B.合金中镁的质量分数为63.3%≤Mg%<100%
C.在产生沉淀后的溶液中一定含有0.2 mol NaAlO2
D.在产生沉淀后的溶液中有1.5 mol Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的短周期部分。
a | |||||||
b | c | d | |||||
e | f | g | h |
请参照元素a-h在表中的位置,根据判断出的元素回答问题:
(1)h原子核外有 _____ 种不同伸展方向的电子云,最外层共有 _____ 种不同运动状态的电子。
(2)比较d、e元素常见离子的半径大小(用化学式表示)_______>__________;b、c 两元素非金属性较强的是(写元素符号)________,写出证明这一结论的一个化学方程式 ___________________ 。
(3)d、e元素形成的四原子化合物的电子式为___________;b、g元素形成的分子bg2为__________分子(填写“极性”或“非极性”)。
(4)上述元素可组成盐R:ca4f(gd 4)2和盐S:ca4agd4 ,相同条件下,0.1 mol/L 盐R中c(ca4+)________(填“等于”、“大于”或“小于”)0.1 mol/L 盐S中c(ca4+)。
(5)向盛有10mL1 mol/L盐S溶液的烧杯中滴加1 mol/L NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是 __________________________________________ 。
(6)向盛有10mL 1 mol/L盐 R溶液的烧杯中滴加1 mol/L NaOH溶液32mL后,继续滴加至35mL写出此时段(32mL—35mL)间发生的离子方程式: _________________________ 。若在10mL 1 mol/L 盐R溶液的烧杯中加20mL1.2 mol/L Ba(OH)2溶液,充分反应后,溶液中产生沉淀的物质的量为__________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
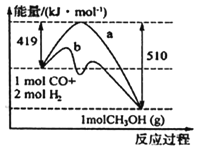
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
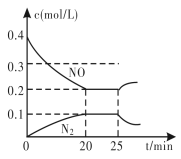
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。
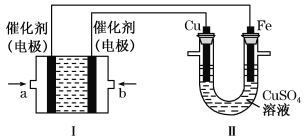
①a处应通入______(填“CH4”或“O2”),a处电极上发生的电极反应式是______________;
②电镀结束后,装置Ⅰ中溶液的pH _________ (填写“变大”“变小”或“不变”,下同),装置Ⅱ中Cu2+的物质的量浓度____________________;
③电镀结束后,装置Ⅰ溶液中的阴离子除了OH-以外还含有________________ ;
④在此过程中若完全反应,装置Ⅱ中阴极质量变化6.4 g,则装置Ⅰ中理论上消耗甲烷__________L(标准状况下)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125℃,反应装置如右图。
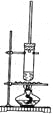
下列对该实验的描述错误的是
A.不能用水浴加热
B.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
C.长玻璃管起冷凝回流作用
D.加入过量乙酸可以提高1-丁醇的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚酯纤维(涤纶)是重要的衣服面料,以下是一种合成路线(部分反应条件略去)。
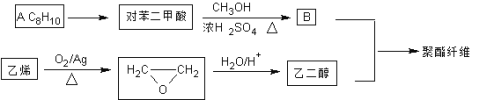
已知:酯与醇(或酚)可发生如下酯交换反应:![]()
(1)C8H10的系统命名为______________;它的同系物分子通式为________________。
(2)在其它催化剂作用下,乙烯与氧气反应的产物是____________(写结构简式)。
(3)若B过量,生成的聚酯纤维可表示为:![]() ,若乙二醇过量,则生成的聚酯纤维可表示为_______________________________。
,若乙二醇过量,则生成的聚酯纤维可表示为_______________________________。
(4)将废涤纶和甲醇在一定条件下反应,对聚合物进行降解,生成物是______________(填名称)。
(5)对苯二甲酸有多种芳香族同分异构体,写出一种满足以下条件的有机物的结构简式________。
①遇氯化铁溶液显紫色;②能发生银镜反应;③有三种不同化学环境的H原子。
(6)聚合物PC也由酯交换反应合成,其结构可表示为:![]() ,合成PC的2种单体中:醇(或酚)的结构简式为______________________,酯的名称为
,合成PC的2种单体中:醇(或酚)的结构简式为______________________,酯的名称为
_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.1000mol/LNaOH溶液滴定20.00mL、0.0100mol/LHCl溶液所得到的滴定曲线
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c < a < b
D.图Ⅳ表示反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
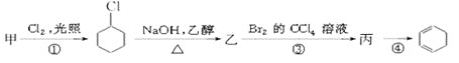
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com