
【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
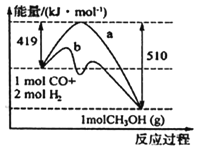
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
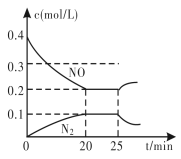
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
【答案】CO(g)+2H2(g)=CH3OH(g) △H=-91 kJ/mol b -524.8 放 50% BC 0.016 mol/(L·min) D
【解析】
(1)根据反应物与生成物的总能量来分析吸热还是放热,并书写热化学反应方程式,催化剂降低反应活化能,但不改变反应热效应;
(2)根据①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol;
②C(s)+H2O(g)=CO(g)+H2(g) △H3=+131.3 kJ/mol;
利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的反应热;
(3)①平衡常数随温度升高减小,说明升高温度,化学平衡逆向进行,逆反应是吸热反应,则该反应的正反应是放热反应;
②依据830℃的化学平衡常数的数值,结合平衡常数的含义计算一氧化碳的转化率;
(4)①根据平衡状态的特征是动态平衡,各物质的量不再随时间变化而变化,据此逐一分析判断;
②从反应开始到5 min,生成了N2 0.08 mol,CO的变化量是0.08 mol×2=0.16 mol,则5 min 内根据v(CO)=![]() 计算;
计算;
③平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
A.缩小容器体积平衡向正反应方向移动;
B.增增加NO的浓度平衡向正反应方向移动;
C.降低温度平衡向正反应方向移动;
D.升高温度平衡向逆反应方向移动。
(1)反应物的总能量为419 kJ,生成物的总能量为510 kJ,则该反应为放热反应,放出的热量为419 kJ-510 kJ=-91 kJ,热化学方程式为CO(g)+2H2(g)=CH3OH(g) △H=-91 kJ/mol;曲线b降低了反应活化能,应该是反应使用了催化剂,故合理选项是b;
(2)根据①C(s)+O2(g)=CO2(g) △H1=-393.5 kJ/mol;
②C(s)+H2O(g)=CO(g)+H2(g) △H3=+131.3kJ/mol,
利用盖斯定律,将①-②可得反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=-393.5kJ/mol-131.3kJ/mol=-524.8 kJ/mol;
(3)①根据图表中平衡常数K与温度的关系,可知:温度升高化学平衡常数减小,说明升高温度,平衡逆向移动,逆反应是吸热反应,则该反应的正反应是放热反应;
②在830℃,平衡常数K=1,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,设反应达到平衡一氧化碳反应物质的量为x,则根据方程式式中物质转化关系可知平衡时各种气体的物质的量n(CO)=n(H2O)=1-x,n(H2)=n(CO2)=x,![]() =1,解得x=0.5 mol,所以达到平衡后CO的转化率=
=1,解得x=0.5 mol,所以达到平衡后CO的转化率=![]() ×100%=50%;
×100%=50%;
(4)①A.该反应达到平衡状态时应有v正(NO)=2v逆(N2),A错误;
B.混合气体的相对分子质量不变,说明气体的总物质的量不变,反应达平衡状态,B正确;
C.气体总压强不变,说明气体的总物质的量不变,反应达平衡状态,C正确;
D.△H只与具体热化学方程式有关,与反应物的量的变化无关,无法判断反应达到平衡状态,D错误;
E.混合气体的体积和质量始终不变,因此混合气体的密度也始终不变,因此不能根据密度不再变化,判断反应是否达到平衡状态,E错误;
故合理选项是BC;
②从反应开始到5 min,生成了N2 0.08 mol,则5 min 内v(CO)= ×2=0.016 mol/(L·min);
×2=0.016 mol/(L·min);
③反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0的正反应为气体体积减小的放热反应,根据图象可知:平衡时一氧化氮的浓度增大,N2的浓度减小,平衡向逆反应方向移动。
N2(g)+2CO2(g) △H<0的正反应为气体体积减小的放热反应,根据图象可知:平衡时一氧化氮的浓度增大,N2的浓度减小,平衡向逆反应方向移动。
A.缩小容器体积,化学平衡向正反应方向移动,A不符合题意;
B.增加NO的浓度平衡,化学平衡向正反应方向移动,B不符合题意;
C.降低温度,化学平衡向正反应方向移动,C不符合题意;
D.升高温度,化学平衡向吸热的逆反应方向移动,D符合题意;
故合理选项是D。


 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:
①Sn(s,白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1
②Sn(s,灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2
③Sn(s,灰)![]() Sn(s,白) △H3=+2.1kJmol-1
Sn(s,白) △H3=+2.1kJmol-1
下列说法正确的是( )
A.△H1>△H2
B.锡在常温下以灰锡状态存在
C.灰锡转为白锡的反应是放热反应
D.锡制器皿长期处在低于13.2℃的环境中,会自行毁坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温恒压容器中充入2 mol NO、1 mol O2,发生反应:2NO(g)+O2(g)![]() 2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
2NO2(g)。下列情况不能说明反应已达到平衡状态的是( )
A.NO与O2的物质的量的比值不再改变B.混合气体的颜色不再改变
C.容器体积不再改变D.混合气体的密度不再改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数约为6.02×1023mol-1,下列说法中一定正确的是( )
A.1L 1 mol·L-1的CH3COOH溶液中含有氢离子数约为6.02×1023
B.18g D2O(重水)完全电解,转移的电子数约为6.02×1023
C.34 g H2O2中含有的阴离子数为约为6.02×1023
D.STP下,14g乙烯和丙烯的混合物中,含有共用电子对数目约为3×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,25 ℃时存在着平衡:2NO2(g)![]() N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
N2O4(g)(正反应放热)。把烧瓶置于100 ℃的水中,则下列几项性质中不会改变的是
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A. ①和③ B. ②和④ C. ④和⑤ D. ③和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温时,将2 mol A和2 mol B气体投入固定容积为2 L的密闭容器中发生反应:2A(g)+B(g)![]() xC(g)+D(s),10 s时,测得A的物质的量为1.7 mol,0~10 s内C的反应速率为0.0225 mol·L-1·s-1;40 s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
xC(g)+D(s),10 s时,测得A的物质的量为1.7 mol,0~10 s内C的反应速率为0.0225 mol·L-1·s-1;40 s时反应恰好处于平衡状态,此时B的转化率为20%。请填写下列空白:
(1)x=________;
(2)平衡时容器中B的体积分数为________;
(3)该温度下此反应的平衡常数表达式为_____________,数值是__________;
(4)下列各项能表示该反应达到平衡状态的是________________________;
A.消耗A的物质的量与生成D的物质的量之比为2∶1
B.容器中A、B的物质的量n(A)∶n(B) =2∶1
C.气体的平均相对分子质量不再变化
D.压强不再变化
E.气体密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:链烃A(C5H8)有支链且只有一个官能团。有机化合物A~H的转换关系如下所示:
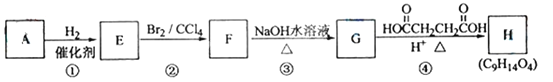
请回答下列问题:
(1)A的结构简式是_________________,名称是________________。
(2)链烃B是A的不同类别的同分异构体,B经催化氢化转化为正戊烷,写出B所有可能的结构简式_________________________________________________________。
(3)写出反应类型:反应②___________________,反应③____________________。
(4)写出反应④的化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烃是由C、H元素组成的有机物、不同有机物的结构不同。试回答下列问题:
(1)分子式为C6H12的某烯烃的所有的碳原子都在同一个平面上,则该烯烃的结构式___,系统命名为___。
(2)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链,它完全燃烧时所消耗的氧气的体积是相同状态下该烃蒸气体积的8.5倍。
(a)若该烃为链状烯烃,并且与等物质的量的Br2加成只能得到某单一产物,则该烃的结构简式为___。
(b)若该烃只能与含等物质的量的Br2四氯化碳溶液发生反应,则其结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____列;As原子能量最高的3个轨道在空间相互____;1个黄砷(As4)分子中含有_____个As﹣As键,键角_____度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____(选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____(选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___H2O →____Ni+____ H2PO3﹣+___H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______。
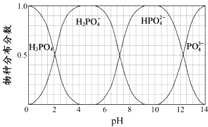
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com