
【题目】磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____列;As原子能量最高的3个轨道在空间相互____;1个黄砷(As4)分子中含有_____个As﹣As键,键角_____度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____(选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____(选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___H2O →____Ni+____ H2PO3﹣+___H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______。
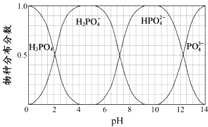
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________。
【答案】15 垂直 6 60 d b 1 1 1 1 1 2 2mol c(HPO42﹣)>c(H2PO4﹣) 4~5.5(介于此区间内的任意值或区间均可)
【解析】
(1)砷(As)为第ⅤA族元素,As原子能量最高的3个轨道为4p,黄砷(As4)分子类似P4结构,为正四面体;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同;
(3)可利用与氢气化合的难易程度、N-H和P-H的键能及最高价含氧酸的酸性等比较非金属性;
(4)镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式;
(5)为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;溶液中主要含磷物种浓度大小关系可由图表得出。
(1)砷(As)为第ⅤA族元素,位于元素周期表第15列,As原子能量最高的3个轨道为4p,在空间相互垂直,黄砷(As4)分子类似P4结构,为正四面体,有6个As﹣As键,键角为60度;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同,存在共价键和分子间作用力,为混合型晶体,故答案为:d;
(3)可利用与氢气化合的难易程度、N﹣H和P﹣H的键能及最高价含氧酸的酸性等比较非金属性,a、c、d均可比较,而b不能,故答案为:b;
(4)①镍元素的化合价降低了2价,磷元素的化合价升高了2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2﹣+H2O═Ni+H2PO3﹣+2H+;
②1mol H2PO3﹣,反应中转移电子的物质的量为1mol×(4﹣2)=2mol;
(5)①由图可知,pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42﹣)>c(H2PO4﹣);
②为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4﹣分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可)。


科目:高中化学 来源: 题型:
【题目】CO和H2可作为能源和化工原料,应用十分广泛。常利用煤气化过程中生成的CO和H2来制备甲醇。
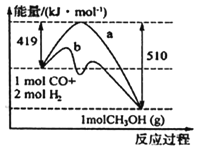
(1)请根据图示写出该反应的热化学方程式:_______________;图中使用催化剂曲线是_______(填“a”或“b”)。
(2)已知:C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
C(s)+H2O(g)=CO(g)+H2(g) ΔH2=+131.3 kJ/mol
则反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)的ΔH=______________kJ/mol。
(3)反应CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
H2(g)+CO2(g)的平衡常数随温度的变化如下表所示。
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
①从上表可以推断:此反应是__________(填“吸”或“放”)热反应。
②在830 ℃下,若开始时向恒容密闭容器中充入CO与H2O均为1 mol,则达到平衡后CO的转化率为___________________。
(4)汽车排气管上的催化转化器发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
N2(g)+2CO2(g) △H<0,在一定温度下,将一定量的NO和CO充入2 L固定容积的容器中,回答以下问题:
①能说明该反应达到平衡状态的是_____________(填字母标号)。
A. 2v正(NO)=v逆(N2) B. 混合气体的平均相对分子质量保持不变
C. 气体总压强不再变化 D. ΔH保持不变
E.混合气体的密度不再变化
②从反应开始到5 min,生成了0.08 mol N2,则5 min内v(CO)=__________mol/(L·min)。
③25 min时,物质浓度变化如图所示,则改变的条件可能是________(填字母标号)。
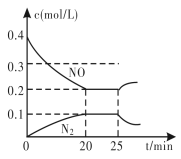
A. 缩小容器体积 B. 增加NO的浓度
C. 降低温度 D. 升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A.图I表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图Ⅱ表示常温下,0.1000mol/LNaOH溶液滴定20.00mL、0.0100mol/LHCl溶液所得到的滴定曲线
C.图Ⅲ表示一定质量的冰醋酸加水稀释过程中,醋酸溶液电离程度:c < a < b
D.图Ⅳ表示反应4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
N2(g)+4CO2(g),在其他条件不变的情况下改变起始物CO的物质的量,平衡时N2的体积分数变化情况,由图可知NO2的转化率c > b > a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,6—己二酸是合成高分子化合物尼龙的重要原料之一,可用六个碳原子的化合物氧化制备。下图是合成尼龙的反应流程:
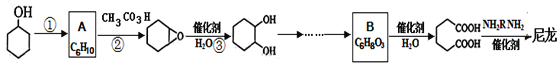
已知:
![]() 2CH3COOH
2CH3COOH
完成下列填空:
(1)写出反应类型:反应①_____反应②__________。
(2)A和B的结构简式为_______、_________。
(3)在上述反应流程的物质中,含氢原子位置不同最多的物质是___________(填名称),最少的物质是________(填结构简式)。
(4)由![]() 合成尼龙的化学方程式为___________。
合成尼龙的化学方程式为___________。
(5)由A通过两步制备1,3—环己二烯的合成线路为:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是
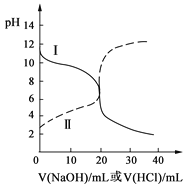
A.曲线Ⅰ:滴加溶液到10 mL时:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线Ⅰ:滴加溶液到20 mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.曲线Ⅱ:滴加溶液在10 mL~20 mL之间存在:c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线Ⅱ:滴加溶液到10 mL时:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
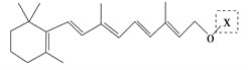
为了研究X的结构,将化合物A在一定条件下水解只得到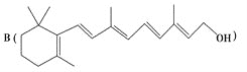 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
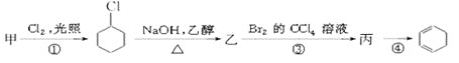
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的变化关系如图所示,则正确的是

A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(Na+)>c(CH3COO-)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时,X、Y、Z的浓度分别为0.1mol·L-1,0.3 mol·L-1,0.08 mol·L-1,则下列判断不合理的是
A. C1∶C2=1∶3 B. 平衡时,Y和Z的生成速率之比为3∶2
C. X、Y的转化率不相等 D. C1的取值范围为0<C1<0.14 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com