
【题目】某温度下,向一定体积0.1 mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH与pH的变化关系如图所示,则正确的是

A.M点所示溶液导电能力强于Q点
B.N点所示溶液中c(Na+)>c(CH3COO-)
C.M点和N点所示溶液中水的电离程度相同
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
【答案】BC
【解析】
酸溶液中pOH越大,说明溶液中氢氧根离子浓度越小,溶液氢离子浓度越大,酸性越强,随着NaOH的加入,发生中和反应,溶液氢氧根离子的浓度逐渐增大,则溶液pOH逐渐减小,pH逐渐增大,结合弱电解质的电离解答该题。
A.由于醋酸是弱酸,电离程度很小,离子浓度也较小,M点溶液的导电能力最弱,A错误;
B.N点所示溶液为碱性,则c(OH-)>c(H+),根据溶液电荷守恒易判断出此时c(Na+)>c(CH3COO-),B正确;
C.由于M点的H+浓度等于N点的OH-浓度,对水的电离程度抑制能力相同,所以两点水电离程度相同,C正确;
D.Q点的pOH=pH,溶液为中性,而两者等体积混合后生成醋酸钠,水解显碱性。则所加NaOH溶液体积略小于醋酸溶液的体积,D错误;
故合理选项是BC。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】烃是由C、H元素组成的有机物、不同有机物的结构不同。试回答下列问题:
(1)分子式为C6H12的某烯烃的所有的碳原子都在同一个平面上,则该烯烃的结构式___,系统命名为___。
(2)组成符合CnH2n-2的某种烃,分子结构中没有支链或侧链,它完全燃烧时所消耗的氧气的体积是相同状态下该烃蒸气体积的8.5倍。
(a)若该烃为链状烯烃,并且与等物质的量的Br2加成只能得到某单一产物,则该烃的结构简式为___。
(b)若该烃只能与含等物质的量的Br2四氯化碳溶液发生反应,则其结构简式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷和砷是同主族的非金属元素。
(1)砷(As)元素位于元素周期表第____列;As原子能量最高的3个轨道在空间相互____;1个黄砷(As4)分子中含有_____个As﹣As键,键角_____度.
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于____(选填编号).
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是_____(选填编号).
a.磷难以与氢气直接化合 b.白磷易自燃 c.P﹣H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍﹣磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2﹣,在酸性条件下发生以下镀镍反应:
___ Ni2++___ H2PO2﹣+___H2O →____Ni+____ H2PO3﹣+___H+
①请配平上述化学方程式。
②上述反应中,若生成1mol H2PO3﹣,反应中转移电子的物质的量为______。
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示。
①pH=8时,溶液中主要含磷物种浓度大小关系为_________________。
②为获得尽可能纯的NaH2PO4,pH应控制在______________________________。
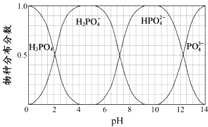
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数,在含4克NaOH溶质的溶液中通入一定量的CO2,将溶液蒸干并灼烧,最后得到的固体是
A.0.1NA的NaHCO3
B.0.05NA Na2CO3
C.0.05NA~0.1NA Na2CO3和NaHCO3混合物
D.0.1NA的NaHCO3和NaOH混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某化学兴趣小组设计了一个燃料电池,并探究氯碱工业原理和粗铜精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)通入氧气的电极为_____(填“正极”或“负极”),通氢气一极的电极反应式为_________________;
(2)铁电极为_______(填“阳极”或“阴极”),乙装置中电解反应的化学方程式为_________________。
(3)若在标准状况下,有1.12 L氧气参加反应,丙装置中阴极增重的质量为______g;
(4)某粗铜中含有铁、金、银和铂等杂质,通过电解精制后,为从电解液中制得硫酸铜晶体(CuSO4·5H2O),设计了如下工艺流程:

已知:几种金属阳离子开始沉淀和沉淀完全的pH:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe3+ | 1.9 | 3.2 |
Fe2+ | 7.0 | 9.0 |
Cu2+ | 4.7 | 6.7 |
①步骤I中加入试剂A的目的是_____________________________,试剂A应选择______(填序号);
a.氯气 b.过氧化氢 C.酸性高锰酸钾溶液
选择该试剂的原因_____________________________________________________;
②步骤II中试剂B为_________,调节pH的范围是___________;
③步骤III的操作是加热浓缩、_______、___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Cr2(SO4)3的水溶液中加入Na0H溶液,当pH=4.6时,开始出现Cr(OH)3沉淀,随着pH的升高,沉淀增多,但当pH≥13时,沉淀消失,出现亮绿色的亚铬酸根离子(CrO2-),其平衡关系为:![]()
向50mL0.05mol/L的Cr2(SO4)3溶液中,加入l.0mol/L的NaOH溶液50mL,充分反应后,溶液中可观察到的现象为
A. 溶液为紫色 B. 溶液中有灰绿色沉淀 C. 溶液为亮绿色 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组对人教版教材实验“在200mL烧杯中放入20g蔗糖(C12H22O11),加入适量水,搅拌均匀,然后再加入15mL质量分数为98%浓硫酸,迅速搅拌”进行如下探究;
(1)观察现象:蔗糖先变黄,再逐渐变黑,体积膨胀,形成疏松多孔的海绵状黑色物质,同时闻到刺激性气味,按压此黑色物质时,感觉较硬,放在水中呈漂浮状态,同学们由上述现象推测出下列结论:
①浓硫酸具有强氧化性 ②浓硫酸具有吸水性 ③浓硫酸具有脱水性④浓硫酸具有酸性 ⑤黑色物质具有强吸附性
其中依据不充分的是_________(填序号);
(2)为了验证蔗糖与浓硫酸反应生成的气态产物,同学们设计了如下装置:

试回答下列问题:
①图1的A中最好选用下列装置_________(填编号);
②图1的 B装置所装试剂是_________;D装置中试剂的作用是_________;E装置中发生的现象是_________;
③图1的A装置中使蔗糖先变黑的化学反应方程式为_________,后体积膨胀的化学方程式为:_________;
④某学生按图2进行实验时,发现D瓶品红不褪色,E装置中有气体逸出,F装置中酸性高锰酸钾溶液颜色变浅,推测F装置中酸性高锰酸钾溶液颜色变浅的原因_________,其反应的离子方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成尿素的反应为:2NH3 (g) +CO2 (g)CO(NH2)2(s) +H2O (g) +Q(Q>0)一定条件下,在10 L的恒容密闭容器中,充入2molNH3和1molCO2。反应经5min后达到平衡,测得容器中的浓度为0.05mol/L。完成下列填空:
(1)平均反应速率v(NH3)=_____________。
(2)下列描述中能说明上述反应已达平衡的是__________(填序号)。
a.2v正(NH3)=v逆(H2O) b.气体的平均相对分子质量不随时间而变化
c. NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产要素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com