
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度是原来的60%,则( )
bB(g)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,A的浓度是原来的60%,则( )
A.平衡向逆反应方向移动了B.物质A的转化率增加了
C.物质B的质量分数增加了D.a<b
科目:高中化学 来源: 题型:
【题目】某汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
2CO2(g)+N2(g) ΔH<0。若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且说明反应在进行到t1时刻达到平衡状态的是( )
A.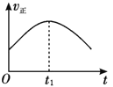 B.
B.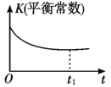
C. D.
D.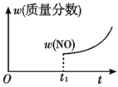
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含铬Cr2O72- 废水用硫酸亚铁铵[FeSO4·(NH4)2 SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n molFeO·FeyCrxO3(Cr化合价+3价) 。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.消耗硫酸亚铁铵的物质的量为n(2-x)molB.处理废水中Cr2O72- 的物质的量为![]() mol
mol
C.反应中发生转移的电子为3nx molD.在FeO·FeyCrxO3中3x=y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图是反应CO(g)+2H2(g) → CH3OH(g)进行过程中的能量变化曲线。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。下列相关说法正确的是
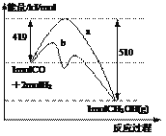
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 510 kJ
D.热化学方程式为CO(g)+2H2(g) → CH3OH(g) + 91 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的氧化铁与氧化铜的混合物,加入稀硫酸(含0.1 mol H2SO4),恰好完全反应成盐和水,原混合物中氧元素的质量是
A.6.4gB.3.2gC.1.6gD.0.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Na2S2,其溶液显黄色并有强碱性。
(1)写出该反应的化学方程式:___________________________________。并写出Na2S2的电子式___________该物质中所具有的化学键的类型_______________;该反应中的Na2S表现了_____________性,当生成1mol Na2S2时,转移电子数目为___________。
(2)在碱性溶液中,多硫化钠Na2Sx(x≥2),可被NaClO氧化为硫酸钠,而NaClO被还原为NaCl,若反应中Na2Sx与NaClO的物质的量之比为1:16,则X的值为________。
A.5 B.4 C.3 D.2
(3)常温下Na2S溶液显______(填酸性、中性或碱性),理由是(用离子方程式表示)__________________________。
(4)常温pH=10的0.1mol/LNaHS溶液中各离子浓度由大到小的顺序是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过如图所示的流程由甲苯氧化制备苯甲醛。
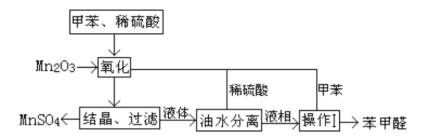
试回答下列问题:
(1)Mn2O3氧化甲苯的反应需要不断搅拌,搅拌的作用是___。
(2)甲苯经氧化后得到的混合物通过结晶、过滤进行分离,该过程中需将混合物冷却,其目的___。
(3)实验过程中,可循环使用的物质分别为___,___。
(4)实验中分离甲苯和苯甲醛采用的操作I是___________。
(5)实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表),
反应时间/h | 1 | 2 | 3 | 4 | 5 |
苯甲醛产率/% | 76.0 | 87.5 | 83.6 | 72.5 | 64.8 |
请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一种丰富的资源,工业生产可以从海水中提取许多有用的物质,这些物质广泛应用于生活、生产、科技等方面。下图是从含碘CCl4溶液得到碘的实验过程:
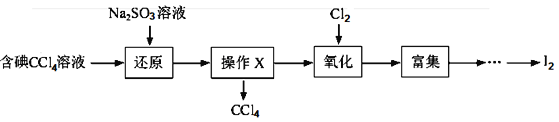
完成下列填空:
(1)向含碘溶液中加入稍过量的Na2SO3溶液,其离子方程式为_________;该操作将I2还原为I-的目的是__________。
(2)操作X的名称为_______,所用的主要仪器是_________。
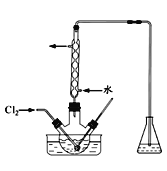
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是_________;锥形瓶里盛放的溶液为________。
(4)已知:5SO32-+2IO3-+2H+ → I2+5SO42-+H2O某含碘溶液(pH约为8)中一定存在I2,可能存在I-、IO3—中的一种或两种。请补充完整检验含碘溶液中是否同时含有I-、IO3-的实验方案:_______。实验中可供选择的试剂:CCl4、稀盐酸、淀粉溶液
(5)浓海水提取镁的工艺流程如下图:
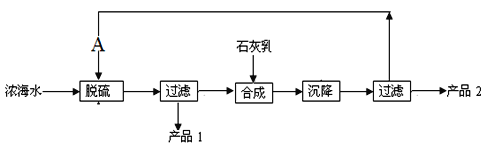
浓海水的主要成分如下:
离子 | Na+ | Mg2+ | Cl- | SO42- |
浓度/(g·L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
该工艺过程中,脱硫阶段主要反应的离子方程式为________,产品2的化学式为__________。1L浓海水最多可得到产品2的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com