
【题目】向![]()
![]() 和
和![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的盐酸,产生
的盐酸,产生![]() 气体的体积(标准状况下)与所加盐酸的体积关系如图所示。
气体的体积(标准状况下)与所加盐酸的体积关系如图所示。
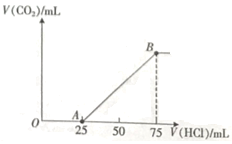
请回答:
(1)OA段反应的离子方程式为____。
(2)混合溶液中![]() 的物质的量浓度为____。
的物质的量浓度为____。
(3)最终产生![]() 气体的体积(标准状况下)为多少mL____?(此小题需写出解题过程)。
气体的体积(标准状况下)为多少mL____?(此小题需写出解题过程)。
【答案】CO32+H+═HCO3 0.25mol/L 根据HCO3+H+=CO2↑+H2O,碳酸氢根离子消耗盐酸的物质的量为:0.1mol/L×(0.0750.025)L=0.005mol,则n(HCO3)=0.005mol,根据碳原子守恒,生成二氧化碳的物质的量为n(CO2)=0.005mol,V(CO2)= 22.4L/mol×0.005mol=0.112L=112mL
【解析】
碳酸钠、碳酸氢钠的混合物中滴入盐酸,碳酸根离子先与氢离子反应生成碳酸氢根离子,然后碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
(1)由分析及图像可知,OA段为碳酸根离子与氢离子反应生成碳酸氢根离子;
(2)根据图象数据及反应方程式计算出碳酸钠的物质的量,再计算出其物质的量浓度;
(3)由于反应物为碳酸钠、碳酸氢钠的混合物,反应后溶液中的碳元素全都生成了二氧化碳,根据碳原子守恒计算出二氧化碳的物质的量,进而算出体积。
碳酸钠、碳酸氢钠的混合物中滴入盐酸,碳酸根离子先与氢离子反应生成碳酸氢根离子,然后碳酸氢根离子与氢离子反应生成二氧化碳气体和水;
(1)由分析及图像可知,OA段为碳酸根离子与氢离子反应:CO32+H+═HCO3,故答案为:CO32+H+═HCO3;
(2)碳酸钠与盐酸反应的离子方程式为:CO32+H+═HCO3,消耗盐酸的物质的量为:0.1mol/L×0.025L=0.0025mol,则碳酸钠的物质的量为:0.0025mol,其物质的量浓度为![]() =0.25mol/L;故答案为:0.25mol/L;
=0.25mol/L;故答案为:0.25mol/L;
(3)根据HCO3+H+=CO2↑+H2O,碳酸氢根离子消耗盐酸的物质的量为:0.1mol/L×(0.0750.025)L=0.005mol,则n(HCO3)=0.005mol,根据碳原子守恒,生成二氧化碳的物质的量为n(CO2)=0.005mol,V(CO2)= 22.4L/mol×0.005mol=0.112L=112mL。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用。电解质溶液为KOH溶液,电池反应为:Cd +2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
Cd(OH)2+2Ni(OH)2,下列有关镍镉电池的说法正确的是
A. 充电过程是化学能转化为电能的过程
B. 充电时阳极反应为Cd(OH)2+2e—="=" Cd + 2OH-
C. 放电时电池内部OH - 向正极移动
D. 充电时与直流电源正极相连的电极上发生Ni(OH)2转化为NiO(OH)的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的化工原料,世界卫生组织国际癌症研究机构公布的致癌物清单初步整理参考,苯乙烯在2B类致癌物清单中。
(1)工业上可用乙苯催化脱氢方法制备苯乙烯,其反应原理如下:
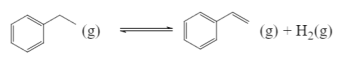
①在容积固定为2L的密闭容器内充人2mol![]() ,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,用压力计监测容器内压强的变化如下:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
压强/MPa | 12.6 | 13.68 | 14.55 | 15.22 | 15.6 | 15.75 | 15.75 |
根据表中数据计算该温度下压强平衡常数Kp_____(计算结果带单位,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
②实际生产中常在恒压条件下掺入高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应)。在一定压强、900K的条件下,苯乙烯的产率随着![]() 的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
的增大而_________(填“增大”“减小”或“不变”)。随着反应的进行,会产生积碳使催化剂活性减弱,水蒸气还有利于恢复催化剂活性,原因是__________(用化学方程式表示)。
(2)研究表明金属次卟啉二甲酯能够顺利地选择性催化氧化苯乙烯生成苯甲醛(结构简式为![]() ),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
),以该反应原理设计成酸性燃料电池,则电池负极的电极反应式为____________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上转移电子的物质的量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学进行SO2的性质实验。在点滴板a、b、c、d处分别滴有不同的试剂,再向Na2SO3固体上滴加数滴浓H2SO4后,在整个点滴板上盖上培养皿,一段时间后观察到的实验现象如表所示。下列说法正确的是( )
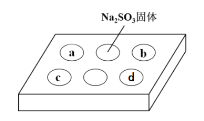
序号 | 试剂 | 实验现象 |
a | 品红溶液 | 红色褪去 |
b | 酸性KMnO4溶液 | 紫色褪去 |
c | NaOH溶液(含2滴酚酞) | 红色褪去 |
d | H2S溶液 | 黄色浑浊 |
A.在浓硫酸与Na2SO3固体反应中,浓硫酸表现的强氧化性
B.a、b均表明SO2具有漂白性
C.c中只可能发生反应:SO2+2OH-=SO32-+H2O
D.d中表明SO2具有氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用![]() 、
、![]() 、
、![]() 分别表示N2、H2、NH3,已知:N2(g)+3H2(g)
分别表示N2、H2、NH3,已知:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92kJ·mol-1
2NH3(g) ΔH=-92kJ·mol-1
下列说法正确的是( )

A.使用催化剂,合成氨反应放出的热量减少
B.②→③过程,是吸热过程且只有H-H键的断裂
C.③→④过程,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收能量小于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
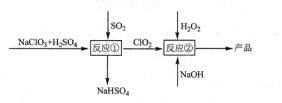
下列说法错误的是( )
A. 反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B. 若反应①通过原电池来实现,则ClO2是正极产物
C. 反应②中的H2O2可用NaClO2代替
D. 反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
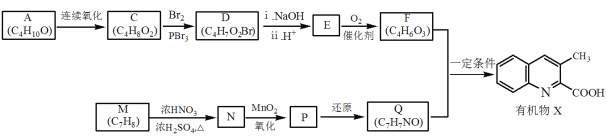
【题目】有机物X是药物的中间体,它的一种合成路线如下。
已知:RNH2+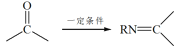 +H2O
+H2O
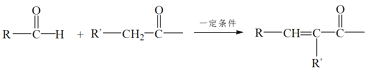
(1)A无支链,A中含有的官能团名称是___。
(2)A连续氧化的步骤如下:
A转化为B的化学方程式是___。
(3)M为芳香化合物,其结构简式是___。
(4)M→N的化学方程式是___,反应类型是___。
(5)下列说法不正确的是___。
a.1molD与NaOH溶液反应时,最多消耗2molNaOH
b.E在一定条件下可生成高分子化合物 
c.F能发生酯化反应和消去反应
(6)Q的结构简式是___。
(7)以乙烯为起始原料,选用必要的无机试剂合成A,写出合成路线___(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲D.平衡时SO2的体积分数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现某些化合物与水反应时,其中所含的一种元素可以发生自身氧化还原反应。
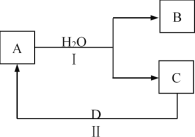
(1)若A为红棕色气体,B为强酸,C为NO。
①D为单质,其所含元素在元素周期表中的位置是___。
②下列说法中,正确的是___(填字母)。
a.A、C的组成元素相同
b.B的浓溶液可与铜反应得到A
c.A、B、C中含有化合价不同的同种元素
(2)若A为淡黄色固体,B为强碱。
①反应Ⅱ的化学方程式是___。
②若得到标准状况下气体C22.4L,则反应Ⅰ中生成B的物质的量是___mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com