
【题目】目前,我国已经有上百个地区的加油站可提供标号为E90、E93的乙醇汽油,它们是在90#、93#汽油中加入了一定量的乙醇而制得。
(1)用玉米生产燃料乙醇的生产如下图表示:
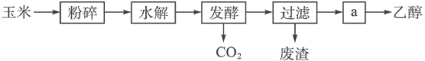
①粉碎玉米的目的是____。步骤a的操作是___。
②以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+ nH2O![]() nC6H12O6
nC6H12O6
C6H12O6![]() 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
100 kg玉米淀粉最多可生产无水乙醇____kg。
(2)乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,可能出现______现象。
(3)常温下,1g乙醇完全燃烧释放29.71kJ热量,请写出乙醇完全燃烧的热化学方程式______。
(4)由玉米等农产品为原料制得的乙醇作燃料,是否是增加大气中CO2的含量,为什么?______。
【答案】增大反应物间的接触面积,加快反应速率,提高原料利用率 蒸馏 56.8 分层 CH3CH2OH(l)+ 3O2(g)= 2CO2(l)+ 3H2O(l) △H=-1366.7kJ·mol—1 不会,以1mol (C6H10O5)n计,光合作用合成时可吸收6n mol CO2,(C6H10O5)n发酵及生成的C2H5OH燃烧共向大气中排放6 n mol CO2,所以不会增加大气中CO2的含量
【解析】
根据题目提供的信息条件及相关化学知识可以判断:
(1)①粉碎玉米的目的是为了增大反应物的接触面积,从而加快反应速率或使反应进行的更充分;步骤a从溶液中得到乙醇,应利用沸点的不同进行分离,操作是蒸馏;
②根据题目提供的反应关系得到如下关系:
(C6H10O5)n~nC6H12O6 ~ 2nC2H5OH
162n 92n
100kg m(C2H5OH)
![]() =
=![]() ,解得m(C2H5OH)=56.8 kg
,解得m(C2H5OH)=56.8 kg
即答案为56.8;
(2)乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,汽油中会出现液体分层的现象,原因是汽油与水互不相溶;
(3)燃烧热是指:在25℃、101kPa时,1mol纯净物完全燃烧生成稳定的氧化物放出的热量,1g乙醇完全燃烧生成CO2和液态水时放热29.71kJ,则1mol乙醇(质量为46g),完全燃烧生成稳定的氧化物放出的热量为46×29.71kJ=1366.7kJ,其燃烧热的热化学方程式为:CH3CH2OH(l)+ 3O2(g)= 2CO2(l)+ 3H2O(l) △H=-1366.7kJ·mol—1;
(4)由玉米等农产品为原料制得的乙醇作燃料,以1mol (C6H10O5)n计,光合作用合成时可吸收6n mol CO2,(C6H10O5)n发酵及生成的C2H5OH燃烧共向大气中排放6 n mol CO2,所以不会增加大气中CO2的含量。


科目:高中化学 来源: 题型:
【题目】A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E 元素的周期序数与主族序数相等。
(1)E 元素在周期表中的位置___________。
(2)写出A2W2的电子式为____________。
(3)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
(4)元素D的单质在一定条件下,能与 A 单质化合生成一种化合物DA,熔点为800℃,DA能与水反应放氢气,若将1molDA和1molE 单质混合加入足量的水,充分反应后成气体的体积是_________(标准状况下)。
(5)D的某化合物呈淡黄色,可与氯化亚铁溶液反应。若淡黄色固体与氯化亚铁反应的物质的量之比为1:2,且无气体生成,则该反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应2NO(g)![]() N2(g)+O2(g)。若在某温度下达到平衡时C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1 该反应的平衡常数为_____________,保持温度不变,将容器体积缩小一半,则平衡常数_________(填增大、减小或不变)。
N2(g)+O2(g)。若在某温度下达到平衡时C(N2)=0.05mol·L-1,C(O2)=0.05mol·L-1,c(NO)=0.1mol·L-1 该反应的平衡常数为_____________,保持温度不变,将容器体积缩小一半,则平衡常数_________(填增大、减小或不变)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对水样中溶质M的分解速率影响因素进行研究。在相同温度下,M的物质的量浓度(mol·L-1)随时间(min)变化的有关实验数据见下表。
时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
Ⅰ(pH=2) | 0.40 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
Ⅱ(pH=4) | 0.40 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
Ⅳ(pH=4,含Cu2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
下列说法不正确的是
A. 在0~20min内,I中M的分解速率为0.015 mol·L-1·min-1
p>B. 水样酸性越强,M的分解速率越快C. 在0~25min内,III中M的分解百分率比II大
D. 由于Cu2+存在,IV中M的分解速率比I快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向100 mL某浓度H2A溶液中加入0.1 mol·L-1 NaOH溶液,所得溶液的pH随NaOH溶液体积的变化曲线如图所示,其中b、c为等当点(等当点指的是按某个方程式恰好反应的点)。下列有关说法不正确的是

A. 起始时,c(H2A)=0.1 mol·L-1
B. b点时:c(Na+)> c(A2-)>c(HA-) > c(H+)>c(OH-)
C. b→c段,反应的离子方程式为HA-+OH-===A2-+H2O
D. c→d段,溶液中A2-的水解程度逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为_____(填字母)nm。
A.435 B500 C.580 D.605 E. 700
(2)元素S和Ca中,第一电离能较大的是_____(填元素符号),其基态原子核外电子排布式为_______。
(3)X射线衍射测定等发现,石膏(CaSO4 2H2O)中存在SO42-离子。SO42-离子的几何构型为_____,中心原子的杂化形式为________。
(4) 基态Ca原子中,核外电子占据最高能层的符号是____,占据该能层电子的电子云轮廓图形状为_____。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金展锰低,原因是_________________。
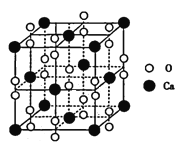
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρ g cm-3,则晶胞结构中最近的两个Ca2+间的距离为______ (列算式即可,用NA表示阿伏加德罗常数的数值)nm,与Ca2+紧邻O22-的个数为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com