
【题目】下列物质属于铁合金的是( )
A.铁水B.氧化铁C.钢D.赤铁矿
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
CH3OH(g)+H2O(g) △H1=-49.58 kJmol-1
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77 kJmol-1
CH3OH(g) △H3=-90.77 kJmol-1
回答下列问题:
(1)反应Ⅱ的△H2=__________,若反应Ⅰ、Ⅱ、Ⅲ平衡常数分别为K1、K2、K3,则K2=________(用K1、K3表示)。
(2)反应Ⅲ自发进行条件是___________(填“较低温度”、“较高温度”或“任何温度”)。
(3)在一定条件下2 L恒容密闭容器中充入3 mol H2和1.5 mol CO2,仅发生反应Ⅰ,实验测得不同反应温度与体系中CO2的平衡转化率的关系,如下表所示。
温度(℃) | 500 | T |
CO2的平衡转化率 | 60℅ | 40℅ |
①T______500℃(填“高于”或“低于”)。
②温度为500℃时,该反应10 min时达到平衡:
a.用H2表示该反应的速率为____________________;
b.该温度下,反应I的平衡常数K=______________。
(4)某研究小组将一定量的H2和CO2充入恒容密闭容器中并加入合适的催化剂(发生反应I、Ⅱ、Ⅲ),测得不同温度下体系达到平衡时CO2的转化率(a)及CH3OH的产率(b),如图所示。
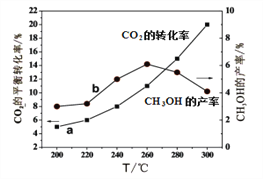
①该反应达到平衡后,为同时提高反应速率和甲醇的生成量,以下措施一定可行的是_____(选填编号)。
A.升高温度 B.缩小容器体积 C.分离出甲醇 D.增加CO2的浓度
②据图可知当温度高于260℃后,CO的浓度随着温度的升高而_________(填“增大”、“减小”、“不变”或“无法判断”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,我国已经有上百个地区的加油站可提供标号为E90、E93的乙醇汽油,它们是在90#、93#汽油中加入了一定量的乙醇而制得。
(1)用玉米生产燃料乙醇的生产如下图表示:
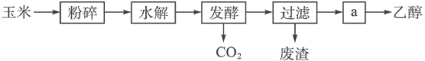
①粉碎玉米的目的是____。步骤a的操作是___。
②以玉米等淀粉原料生产乙醇的化学反应可用下式表示:
(C6H10O5)n+ nH2O![]() nC6H12O6
nC6H12O6
C6H12O6![]() 2C2H5OH + 2CO2↑
2C2H5OH + 2CO2↑
100 kg玉米淀粉最多可生产无水乙醇____kg。
(2)乙醇汽油在储存和运输过程中应特别注意防水。如果乙醇汽油中混入了水,可能出现______现象。
(3)常温下,1g乙醇完全燃烧释放29.71kJ热量,请写出乙醇完全燃烧的热化学方程式______。
(4)由玉米等农产品为原料制得的乙醇作燃料,是否是增加大气中CO2的含量,为什么?______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是干电池的生产和消费大国。某科研团队设计了以下流程对废旧碱性锌锰干电池的资源进行回收:

已知:
①Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24
②Mn(OH)2开始沉淀时pH为8.3,完全沉淀的pH为9.8
③ 0.1 mol/L NaHCO3溶液的pH约为8;0.1 mol/L Na2CO3溶液的pH约为11。
(1)碱性锌锰干电池是以锌粉为负极,二氧化锰为正极,氢氧化钾溶液为电解质。电池总反应为:2MnO2+Zn+2KOH= 2MnOOH+K2ZnO2,请写出电池的正极反应式________________________________;
(2)为了提高碳包的浸出效率,可以采取的措施有______________________________;(写一条即可)
(3)向滤液1中加入MnS的目的是__________________________________________;
(4)已知MnSO4的溶解度曲线如图所示,从滤液2中析出MnSO4·H2O晶体的操作是蒸发结晶、____________________、洗涤、低温干燥;

(5)为了选择试剂X,在相同条件下,分别用3 g碳包进行制备MnSO4的实验,得到数据如下表,请写出最佳试剂X与碳包中的主要成分发生反应的化学方程式________________。
实验编号 | 试剂X | MnSO4/g |
1 | 锌粉 | 2.4 |
2 | 铁粉 | 2.7 |
3 | FeS粉末 | 3.0 |
4 | 30%过氧化氢 | 3.7 |
(6)工业上经常采用向滤液2中加入NaHCO3溶液来制备MnCO3,不选择Na2CO3溶液的原因是_______________________________________;
(7)该科研小组利用EDTA(乙二胺四乙酸二钠,阴离子简写为Y2-)进行络合滴定,测定Mn元素在电池中的质量百分数。
实验过程如下:
①将一节废旧碱性锌锰干电池拆解后,去除金属、碳棒以及外包装后;
②准确称取固体粉末1.200 g;
③经过水浸…等步骤得到滤液1(<100 mL);
④将滤液1稀释至100.00 mL;
⑤取20.00 mL溶液用0.0500 molL-1EDTA标准溶液滴定;在一定条件下,只发生反应:Mn2++Y2-=MnY。
⑥重复滴定3次,平均消耗标准溶液22.00 mL。
则Mn元素的质量百分数为________。(保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是( )
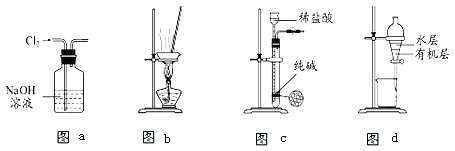
A. 用图(a)所示装置除去Cl2中含有的少量HCl
B. 用图(b)所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体
C. 用图(c)所示装置制取少量纯净的CO2气体并控制反应的发生和停止
D. 用图(d)所示装置分离CCl4萃取碘水后已分层的有机层和水层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,22.4 L CCl4中含CCl4分子数为NA
B. 5.6 g铁和6.4 g铜分别与0.1 mol氯气完全反应,转移的电子数相等
C. 0.1 mo1·L-1 MgCl2溶液中含Cl-数为0.2NA
D. 3.9 g Na2O2 晶体中含有的离子总数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机化合物的结构简式可进一步简化,如:
![]()
根据题目要求回答下列问题:
①有机物 ![]() 与氢气发生化学反应的化学方程式为(用结构简式书写): _________________________________________,该有机化学反应的类型是____________。
与氢气发生化学反应的化学方程式为(用结构简式书写): _________________________________________,该有机化学反应的类型是____________。
②β-月桂烯的结构简式为![]() ,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有_________种。
,一分子该物质与两分子溴发生加成反应的产物(只考虑位置异构)理论上最多有_________种。
(2)下列几种烃类物质:

① 正四面体烷的二氯取代产物有__________种;立方烷的二氯取代产物有__________种。
② 关于苯和环辛四烯的说法正确的是___________(填字母符号)。
A 都能使酸性KMnO4溶液褪色
B 都能与H2发生加成反应,等质量的苯和环辛四烯消耗H2的物质的量之比为3:4
C 都是碳碳单键和碳碳双键交替结构
D 都能发生氧化反应
(3)下图是石蜡油在炽热碎瓷片的作用下分解产生某种气体,并验证其性质的装置:

回答下列问题:
① 该气体可以衡量一个国家的石油化工生产水平,该气体的结构简式是___________。
② B中酸性高锰酸钾溶液和C中溴的四氯化碳溶液都褪色,说明该气体能被酸性高锰酸
钾__________。在C中发生的化学反应方程式为________________________________,反应类型为_________。
③ 由乙炔可以制取甲苯,甲苯一溴代物的同分异构体有________种,其中对溴甲苯的结构
简式为__________________。
④ 甲苯可用于制造烈性炸药TNT,该反应的化学方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)△H1
2 H2(g)+ O2(g)= 2H2O(g)△H2
C(s)+ O2(g)=CO2(g)△H3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的△H为
A. 12△H3+5△H2-2△H1 B. 2△H1-5△H2-12△H3
C. 12△H3-5△H2-2△H1 D. △H1-5△H2-12△H3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com