
【题目】在标准状况下,一氧化碳和二氧化碳的混合气体5.6L,如果二氧化碳的质量为2.2g,则一氧化碳的质量为( )
A. 5.6g B. 4.4g C. 2.8g D. 1g
科目:高中化学 来源: 题型:
【题目】2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele),如图甲。有一种有机物的键线式也酷似牛,故称为牛式二烯炔醇(cowenynenyonl),如图乙。已知连有四个不同的原子或原子团的碳原子,称为手性碳原子。下列有关说法不正确的是( )
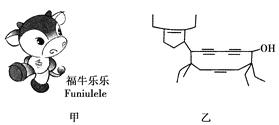
A. 牛式二烯炔醇含有三种官能团
B. 牛式二烯炔醇含有三个手性碳原子
C. 1 mol 牛式二烯炔醇最多可与6 mol Br2发生加成反应
D. 牛式二烯炔醇分子内能发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒(23V)是我国的丰产元素,广泛用于催化及钢铁工业。回答下列问题:
(1)钒在元素周期表中的位置为_______,其价层电子排布图为____________。
(2)钒的某种氧化物的晶胞结构如图1所示。晶胞中实际拥有的阴、阳离子个数分别为____、_____。
(3)V2O5常用作SO2转化为SO3的催化剂。SO2分子中S原子价层电子对数是__对,分子的立体构型为___;SO3气态为单分子,该分子中S原子的杂化轨道类型为____;SO3的三聚体环状结构如图2所示,该结构中S原子的杂化轨道类型为___;该结构中S—O键长有两类,一类键长约140pm,另一类键长约为160pm,较短的键为__(填图2中字母),该分子中含有___个σ键。

(4)V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为___;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构,则偏钒酸钠的化学式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题
Ⅰ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请 回答下列问题:
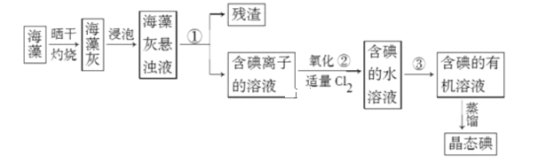
(1)指出提取碘的过程中有关实验操作①和③的名称:________;________。
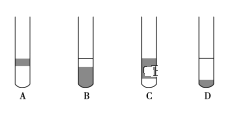
(2)在 3 mL 碘水中,加入 1 mL 四氯化碳,振荡、静置后,观察到试管里的分层现象是下图中的________ (注:试管中深色区为紫红色溶液)。
Ⅱ.欲配制 480mL0.5mol·L-1 的 NaOH 溶液,试回答下列问题。
(3)配制上述溶液需要的仪器有:药匙、托盘天平、量筒、玻璃棒、________。
(4)应称取的 NaOH 固体的质量为________ g。
(5)某学生实际配制的 NaOH 溶液的浓度为 0.51mol·L-1,原因可能是_________。
A.使用滤纸称量 NaOH 固体 B.容量瓶中原来存有少量水
C.溶解后的烧杯未经多次洗涤 D.用胶头滴管加水定容时俯视刻度
E.加水时超过刻度线,用胶头滴管吸出 F.转移溶液之前未经冷却
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL 0.1mol·L1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A.x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)=c(SO42-) >c(Al3+)
B.x=15时,溶液中有NH4+、SO42-,且c(NH4+)<2c(SO42-)
C.x=20时,溶液中有NH4+、Al3+、OH-,且c(OH-)<c(Al3+)
D.x=30时,溶液中有Ba2+、AlO2-、OH-,且c(OH-) = c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示,且实验测得A室混合气体的质量为34 g。则下列说法中不正确的是( )
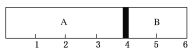
A. A室中混合气体所含分子总数为2NA
B. A室中混合气体的密度是同温同压下氢气密度的8.5倍
C. A室中混合气体中H2与O2的物质的量之比为1:1
D. 将A室H2、O2的混合气体点燃引爆,恢复到室温后,最终活塞恰好停留在3刻度处
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5 min |
块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30 min |
(1)写出大试管中发生反应的化学方程式:_________________,该反应是______反应(填放热[或吸热)。
(2)实验结果表明,催化剂的催化效果与_____________________________有关。
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0—3分钟各物质的量的变化情况如图所示(A,B,C均为气体)。
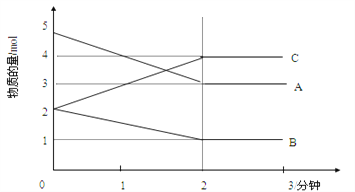
(3)该反应的的化学方程式为_____________________________________________;
(4)反应开始至2分钟时,B的平均反应速率为_____________________________。
(5)能说明该反应已达到平衡状态的是________________________。
a.v(A)= 2v(B)
b.容器内压强保持不变
c.2v逆(A)= v正(B)
d.容器内混合气体的密度保持不变
(6)在密闭容器里,通入a mol A (g)、b mol B (g)、c molC(g),发生上述反应,
当改变下列条件时,反应速率会减小的是____。
A.降低温度B.加入催化剂(正)C.增大容器体积
Ⅲ.(7)为了减缓过量Zn与盐酸产生氢气的反应速率而又不减少产生氢气的量,在盐酸中分别加入下列物质:
A.H2O
B.NaCl溶液
C.Na2CO3溶液
D.Na2NO3溶液
E.CuSO4粉末
你认为可行的是(填编号)________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 ⑦混合气体的压强不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com