
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在一恒容的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2∶2∶1的状态 ④混合气体的颜色不再改变的状态 ⑤混合气体的密度不再改变的状态 ⑥混合气体的平均相对分子质量不再改变的状态 ⑦混合气体的压强不再改变的状态
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. ①②③④⑤⑥
【答案】A
【解析】①用不同物质的反应速率表示达到平衡,反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成氧气,反应向正反应方向进行,生成NO2反应方向向逆反应方向进行,且两者比值等于化学计量数之比,①能表示反应达到平衡,故①正确;②根据①的分析,②不能说明反应达到平衡,故②错误;③任何时刻三者速率之比等于2:2:1,③不能说明反应达到平衡,故③错误;④NO2红棕色气体,其余为无色气体,因此当气体颜色不再改变,说明反应达到平衡,故④正确;⑤根据ρ=m/V,组分都是气体,则气体质量不变,是恒容容器,气体体积不变,因此密度任何时刻都相等,即密度不变,不能作为达到平衡的标志,故⑤错误;⑥根据M=m/n,组分都是气体,气体质量不变,向正反应方向进行,气体物质的量增大,因此当气体平均摩尔质量不变时,说明反应达到平衡,故⑥正确;⑦因为反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故⑦正确;综上所述,选项A正确。


科目:高中化学 来源: 题型:
【题目】已知: 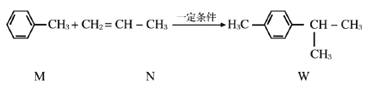 下列说法不正确的是
下列说法不正确的是
A. M、N和W均能发生氧化反应、加成反应和取代反应
B. M不能使溴水因发生化学反应而褪色
C. M与足量的H2反应后的产物的一氯代物有4种
D. W的所有碳原子不可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,一氧化碳和二氧化碳的混合气体5.6L,如果二氧化碳的质量为2.2g,则一氧化碳的质量为( )
A. 5.6g B. 4.4g C. 2.8g D. 1g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式为______________________,该化合物是通过________键形成的。
(2)Na3N与盐酸反应生成________种盐,其电子式是_________________。
(3)Na3N与水的反应属于________反应。
(4)比较Na3N中两种粒子的半径大小________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论均正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 25℃,两片相同的Al片分别和等体积的稀HNO3和浓HNO3反应 | 前者产生无色气体,后者产生红棕色气体,且后者反应更加剧烈 | 其他条件相同时,反应物浓度越大,反应速率越快 |
B | 往黄色固体难溶物PbI2中加水,振荡,静置。取上层清液,然后加入NaI固体 | 产生黄色沉淀 | 难溶物PbI2存在沉淀溶解平衡 |
C | 向蛋白质溶液中分别加入乙醇溶液和(NH4)2SO4饱和溶液 | 均产生白色沉淀 | 蛋白质均发生了变性 |
D | 向稀硫酸中加入铜片,然后通入氧气加热 | 开始无明显现象,通入氧气加热后溶液变蓝 | 氧化性:稀硫酸> Cu2+ |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4和S的燃烧热分别为a kJ/mol 和b kJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和液态水。反应的热化学方程式为______________。(△H用含a、b的代数式表示)
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:

①分析可知X为_______________(写化学式),0~t1时间段的反应温度为_______________,0~t1时间段用SO2表示的化学反应速率为______________________;
②总反应的化学方程式为___________________________________________;
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
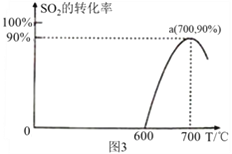
①该反应的ΔH______0(填“>”或“<”);
②700℃的平衡常数为_____________________;
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为___________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为___________。(已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,A、B、C三个容器中均进行同一个反应:N2(g)+3H2(g) ![]() 2NH3(g) ΔH =- Q kJ·mol-1,在相同的时间段内,测得如下数据:
2NH3(g) ΔH =- Q kJ·mol-1,在相同的时间段内,测得如下数据:
容器 | A | B | C |
反应速率/mol·L-1·min-1 | v(H2) = 3 | v(N2) = 3 | v(NH3) = 4 |
则三个容器放出的热量Q的大小关系为( )
A. B > C > A B. A > B > C C. C > A > B D. B > A > C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微型直接甲醇燃料电池能量密度高,可应用于各类便携式电子产品,其工作原理如图所示。下列说法不正确的是
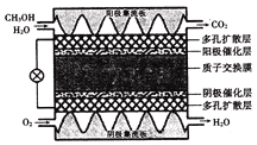
A. 多孔扩散层可起到传导电子的作用
B. 负极上直接通入无水甲醇可提高电池的比能量
C. 当电路中通过3mol e- 时,内电路中有3mol H+ 透过质子交换膜
D. 电池工作时,H+ 向阴极催化层迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com