
| ������ʱ�䣨s�� n��mol�� | 0 | 20 | 40 | 60 | 80 | 100 |
| n��N2O4�� | 0.40 | a | 0.20 | c | d | e |
| n��NO2�� | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
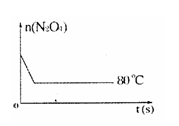
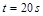 ʱ�������ɵ�
ʱ�������ɵ�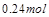 ��
�� ���ɷ�Ӧ�Ļ�ѧ����ʽ
���ɷ�Ӧ�Ļ�ѧ����ʽ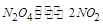 ֪��ʱ����
֪��ʱ����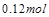
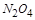 �����ķ�Ӧ����
�����ķ�Ӧ����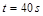 ʱ��ʣ���
ʱ��ʣ���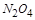 Ϊ
Ϊ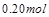 ����
����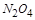 �ı仯��Ϊ
�ı仯��Ϊ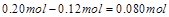 ����
����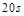 ��
��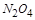 ������Ӧ��ƽ������Ϊ
������Ӧ��ƽ������Ϊ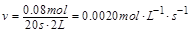 .
.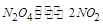 ֪����
֪����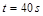 ʱ��
ʱ��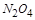 �ı仯��Ϊ
�ı仯��Ϊ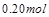 �������ɵ�
�������ɵ� Ϊ
Ϊ ����
����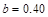 ��ͬ���ɵ�
��ͬ���ɵ�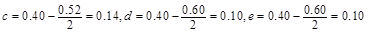
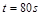 ��Ӧ�ﵽƽ�⣬��ʱ
��Ӧ�ﵽƽ�⣬��ʱ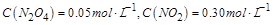 ������ƽ�ⳣ��Ϊ
������ƽ�ⳣ��Ϊ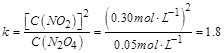
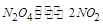 ֪����Ӧ��ǰ������б仯��������ѹǿ����ʱ��ȷ����Ӧ�ﵽ��ƽ��״̬����
֪����Ӧ��ǰ������б仯��������ѹǿ����ʱ��ȷ����Ӧ�ﵽ��ƽ��״̬���� ��ȷ��
��ȷ��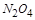 �ֽ�Ϊ
�ֽ�Ϊ ���ٶ���
���ٶ��� �ϳ�Ϊ
�ϳ�Ϊ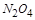 ���ٶ���ͬ���������淴Ӧ����ȣ��ʷ�Ӧ�ﵽ��ƽ��״̬������
���ٶ���ͬ���������淴Ӧ����ȣ��ʷ�Ӧ�ﵽ��ƽ��״̬������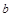 ��ȷ��
��ȷ��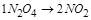 ������v��(NO2)��v��(N2O4)ʱ��������Ӧ���ٶȴ����淴Ӧ���ٶȣ���Ӧû�дﵽƽ�⣬��
������v��(NO2)��v��(N2O4)ʱ��������Ӧ���ٶȴ����淴Ӧ���ٶȣ���Ӧû�дﵽƽ�⣬��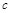 ����
����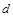 ����
����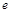 ��ȷ��
��ȷ��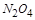 ��ת����Ϊ
��ת����Ϊ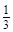 ������˵����Ӧ�ﵽ��ƽ��״̬����
������˵����Ӧ�ﵽ��ƽ��״̬����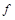 ��.
��.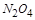 ת��Ϊ
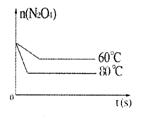
ת��Ϊ �ķ�Ӧ�����ȷ�Ӧ������¶Ƚ��ͣ�
�ķ�Ӧ�����ȷ�Ӧ������¶Ƚ��ͣ�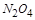 ��ת���ʽ��ͣ�
��ת���ʽ��ͣ� ��Ũ�ȱ�С������ɫ��dz��
��Ũ�ȱ�С������ɫ��dz��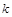 Ϊ��ֵ�����
Ϊ��ֵ�����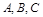 ������ȷ��
������ȷ�� �ķ����ƶ���
�ķ����ƶ���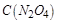 ��С��
����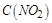 ������
������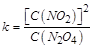 ���
���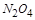 ת��Ϊ
ת��Ϊ �ķ�Ӧ�����ȷ�Ӧ���¶�Խ�ͣ�Խ������
�ķ�Ӧ�����ȷ�Ӧ���¶�Խ�ͣ�Խ������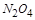 ��ת�������ƽ��ʱ
��ת�������ƽ��ʱ ��Ũ��Խ�ߣ�ͬʱ�ﵽƽ���ʱ��ҲԽ��.
��Ũ��Խ�ߣ�ͬʱ�ﵽƽ���ʱ��ҲԽ��.



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
| A��22��2% | B��27��55% | C��33��3% | D��36��8% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��80.0% | B��20.0% | C��16.7% | D��83.3% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO(g)+H2O(g)����H=" Q" KJ/mol�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£�
CO(g)+H2O(g)����H=" Q" KJ/mol�仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���£�| t�� | 700 | 800 | 850 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 CO2(g)+H2(g)�ڹ̶��ݻ����ܱ������н��У����������ʵ�Ũ�ȱ仯���±���
CO2(g)+H2(g)�ڹ̶��ݻ����ܱ������н��У����������ʵ�Ũ�ȱ仯���±���| ʱ��(min) | CO | H2O | CO2 | H2 |
| 0 | 0.200 | 0.300 | 0 | 0 |
| 2 | 0.138 | 0.238 | 0.062 | 0.062 |
| 3 | c1 | c 2 | c 3 | c 3 |
| 4 | c 1 | c 2 | c 3 | c 3 |
| 5 | 0.116 | 0.216 | 0.084 | |
| 6 | 0.096 | 0.266 | 0.104 | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 C��D������ѹǿʱ��Ӧ���ʱ仯����ͼ��ʾ�������й��ڸ�����״̬��˵����ȷ����
C��D������ѹǿʱ��Ӧ���ʱ仯����ͼ��ʾ�������й��ڸ�����״̬��˵����ȷ����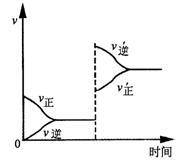
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������

 XeF4(g)��F2(g)��
XeF4(g)��F2(g)���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CH3OH(g)��H2O(g) ��H����49.0kJ/mol
CH3OH(g)��H2O(g) ��H����49.0kJ/mol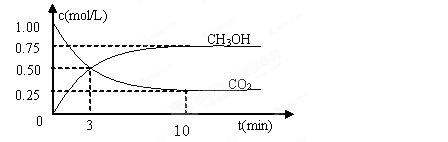
| A�������¶� | B������He(g)��ʹ��ϵѹǿ���� |
| C����H2O(g)����ϵ�з��� | D���ٳ���1mol CO2��3mol H2 H2 |
 ͬ�����ʵ�v����v���Ĺ�ϵ: v�� v�� (���������)
ͬ�����ʵ�v����v���Ĺ�ϵ: v�� v�� (���������)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 2C(g) + D(g)���ﵽƽ��ʱC��Ũ��Ϊ0.4 mol��L����ά����ͬ���¶Ⱥ���ͬ���ݻ������������������Ϊ��ʼ���ʣ��ﵽ��ƽ��ʱC��Ũ������1.2mol/L��
2C(g) + D(g)���ﵽƽ��ʱC��Ũ��Ϊ0.4 mol��L����ά����ͬ���¶Ⱥ���ͬ���ݻ������������������Ϊ��ʼ���ʣ��ﵽ��ƽ��ʱC��Ũ������1.2mol/L��| A��4 mol A+2 mol B | B��3mol C+1 mol D+1 mol B |
| C��3 mol C+ 2mol D | D��1.6mol A+0.8 mol B+0.6 mol C |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com