
����Ŀ����˫����ѧ2017����ѧ�ڵڶ�����Ӧ�Կ��ԡ�ij����Һ����Ҫ�ɷ�ΪNaCl��NaClO���ڿ�����������CO2�����ʣ���NaCl��NaClO�����������¿ɷ�����Ӧ��ClO- + Cl- + 2H+ = Cl2��+ H2O��ijѧϰС����̽��������Һ�ı��������
��1��ȡ��������Һ�����Թ��У���������һ��Ũ�ȵ����ᣬ������ų���ͨ������װ�ü�������ijɷֿ����ж�����Һ�Ƿ���ʡ�

ѧϰС���о�����Ϊ����������������֣��ף����ֱ��ʣ��ң�δ���ʣ�����______��
Ϊ����֤����Ϊ�ף����������ʵ�鷽������ѡ�Լ���
A��98%��Ũ���� B��1%��Ʒ����Һ C��1.0 mol��L-1��KI-������Һ
D��1.0 mol��L-1 ��NaOH��Һ e.����ʯ��ˮ f.����NaCl��Һ
�����Լ� | Ԥ������ͽ��� |
�Թ�A�м�����______(����ţ��� �Թ�B�м�1%Ʒ����Һ�� �Թ�C�м�______(�����)�� | ��A��________�� B��________�� C��________����׳����� |
��2���õζ����ⶨ����Һ��NaClO��Ũ�ȡ�
����ʹ�õζ���֮ǰ���Ƚ��еIJ�����_____________________��
����ȡ25.00 mL����Һ������ƿ�У����������a mol��L-1 Na2SO3��Һv1 mL������Ӧ�Ļ�ѧ����ʽΪ��NaClO + Na2SO3 = NaCl+ Na2SO4����b mol��L-1���������ữ��KMnO4��Һװ��_________(����������)�У��ζ�ʣ���Na2SO3��Һ����Ӧ�Ļ�ѧ����ʽΪ��_______________������Һ��__________(��ζ��յ�����)ֹͣ�ζ�����¼���ݡ�
���ظ������ζ�����2�Σ�ƽ����������KMnO4��Һv2 mL��������Һ��NaClO��Ũ��___mol��L-1(�ú�a��b��v1��v2�Ĵ���ʽ��ʾ)��
���𰸡�ȫ������ c A����Һ����ɫ B����Һ����ɫ e C����Һ����� ���ζ����Ƿ�©Һ�����©�� ��ʽ�ζ���
2KMnO4+5Na2SO3+3H2SO4��K2SO4+2MnSO4+5Na2SO4+3H2O ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ (2av1-5bv2)/50
����������1���������⣬����������������֣��ף����ֱ��ʣ��ң�δ���ʣ�����ȫ�����ʣ�Ҫ˵�����ֱ��ʣ�����Ҫ��������������������Ͷ�����̼��Ҫ�Ⱦ������������ҳ�ȥ����������A�м���������1.0 mol��L-1��KI-������Һ�����鲢��ȥ������B�м���Ʒ����Һ���������Ƿ������Cװ���м������ʯ��ˮ���������̼���ʴ�Ϊ��ȫ�����ʣ� c��A����Һ����ɫ��B����Һ����ɫ��e��C����Һ�����
��2������ʹ�õζ���֮ǰҪ��©���ʴ�Ϊ�����ζ����Ƿ�©Һ��
���������ữ��KMnO4��Һ���������ԣ��ܹ���ʴ�齺�ܣ�ʹ��ʱֻ��װ����ʽ�ζ����У����������Na2SO3��Һ����Ӧ�Ļ�ѧ����ʽΪ2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O������Һ����ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ����ʾ�ﵽ�˵ζ��յ㣬�ʴ�Ϊ�����ζ����Ƿ�©Һ(���©)����ʽ�ζ��ܣ�2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O ������ɫ��Ϊdz��ɫ���Ұ���Ӳ���ɫ��
�����ݵ�ʧ�����غ㣬��������ʧȥ�ĵ����ɸ�����غʹ��������������ʵõ���Na2SO3�����ʵ���Ϊv1 ��10-3L��a mol/L= a v1 ��10-3mol��KMnO4�����ʵ���Ϊv2 ��10-3L��b mol/L=b v2��10-3mol������KMnO4��Ӧ���������Ʒ�Ӧ�����ʵ���Ϊ![]() b v2��10-3mol����������Ʒ�Ӧ���������Ʒ�Ӧ�����ʵ���Ϊa v1 ��10-3mol -
b v2��10-3mol����������Ʒ�Ӧ���������Ʒ�Ӧ�����ʵ���Ϊa v1 ��10-3mol -![]() b v2��10-3mol=�����(a v1 ��10-3 -
b v2��10-3mol=�����(a v1 ��10-3 -![]() b v2��10-3)mol����c(NaClO)=
b v2��10-3)mol����c(NaClO)= 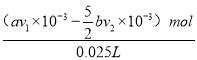 =
=![]() mol/L���ʴ�Ϊ��
mol/L���ʴ�Ϊ�� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������,�ܹ�����ĵ������
A. Cu B. ���ڵ�MgCl2 C. ϡ���� D. ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CO��CO2�Ļ�����壬�ڱ�״���µ����Ϊ11.2L����ش��������⣺
��1���û�������ܵ����ʵ���Ϊ_______��
��2�����������̼ԭ�ӵĸ���Ϊ___________������NA��ʾ�����ӵ�������ֵ��
��3��Ϊ�ⶨ����������ɣ����û������ȫ��ͨ����ͼװ�ý���ʵ�顣���ⶨ��Aƿ�еõ���ɫ����19.7g��
����Aƿ�л�ó��������IJ�����_____________________������
��Ba(OH)2��ҺŨ�ȵIJⶨ���������£�
a������A��Һ���õ���Һ100mL��������Һ�����С�仯��
b����Bƿ�е���Һ���1L��Һ
c����Bƿ���Ƶ���Һ��������100mL��Һ��ֱ�����ٲ�������������������Һ50mL��
����c�еõ��ij��������ʵ���Ϊ______________�� ԭBa(OH)2��Һ��Ũ��Ϊ___________��
���������ռ��������������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ִ�ѧ������ѧ2017��ڰ˴�ģ�⿼������������������˷ܼ�����ϳ�·����ͼ��ʾ��NBS��һ��ѡ��������Լ���

��֪��![]()
��1������AΪ������Է�������Ϊ92��A�Ľṹ��ʽ��________________��
E�й����ŵ�����Ϊ___________________��
��2����ӦB��C�ķ�Ӧ�������Լ���_______________�����ķ�Ӧ������________��
��3��F�Ľṹ��ʽ��____________________________��
��4��д��C��D�Ļ�ѧ����ʽ______________________________________��
��5��������F�ķ�����ͬ���칹���ж��֣�M��N�����е����࣬���ǵĽṹ���������£�
����֪M��FeCl3��Һ������ɫ��Ӧ���ܺ�������Һ����������Ӧ��������ֻ��������λȡ��������M�Ľṹ��ʽ����Ϊ___________________________________��
����֪N�����к��м����ܷ���ˮ�ⷴӦ��������ֻ��һ��ȡ��������N�Ľṹ��_____�֡�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������滷�������ɳ�����չ�ĽǶȿ��ǣ��������һ��ȼ����
A. ���� B. ú C. ���� D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƫ������(C2H8N2)��һ�ָ���Һ̬ȼ�ϣ���ȼ�ղ����ľ���������Ϊ�������ػ�����ƶ���������������ȷ����
A. NA��ƫ�����·��ӵ�����Ϊ60g
B. ��״����,1molƫ�����µ����ԼΪ22.4L
C. ƫ�����µ�Ħ������Ϊ60g
D. 6gƫ�����·����к���0.1NA��N2����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ����Ҫ�л��ϳ��м��壬ʵ���ҿ������·�Ӧ�ϳɣ�
C6H6+HNO3![]() C6H5��NO2+H2O ��H<0
C6H5��NO2+H2O ��H<0
��֪��
���÷�Ӧ���¶��Ըߵ�����»����ɼ����������
���Ʊ���Ӧװ�ã�

������������
���� | �۵�/�� | �е�/�� | �ܶ�/g��cm3 | �ܽ��� |
�� | 5.5 | 80 | 0.88 | ����ˮ |
������ | 5.7 | 211 | 1.205 | ������ˮ |
��������� | 89 | 301 | 1.57 | ����ˮ |
Ũ���� | 83 | 1.4 | ������ˮ | |
Ũ���� | 338 | 1.84 | ������ˮ |
��ش��������⣺
��1���ϳ��������ķ�Ӧ����Ϊ_____________��
��2���Ʊ�ʱ��Ҫ����25 mL��Ũ�����x mL��0.552 mol��Ũ���ᣨ98%�����Һ�������Ӧ��ʢ����_____________�У���д�������ƣ���xֵΪ_____________��
��3����Ӧ��50����60���½��У�����Ҫԭ�������__________________________��д���㼴�ɣ������õķ�����__________________________��
��4����Ӧ������õ��������л����������ʣ��轫��ӦҺ��ȴ�����º����Һ©���У�����������ˮ��5%NaOH��Һ��ˮϴ�Ӳ���Һ���ڶ�����ˮϴ��Ŀ����__________________________��
��5�����з�Һ���������к�������ˮ�ּ��л������ʣ�������ˮaCl2����������Ƭ�̣�Ȼ����������ƿ����ȥCaCl2��������������������ʵ�鷽��Ϊ__________________________����ʵ�鰲ȫ�Ƕȿ��ǣ������������У�Ӧѡ�ÿ��������ܣ���ѡ��ͨˮ��ֱ�������ܵ�ԭ����__________________________________��
��6������Ӧ��ʼʱ������A�м���19.5 mL������Ӧ����ᴿ��õ�20 g����������ʵ�����õ�������������Ϊ_____________����ȷ��0.1%����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��B����ȴװ��δ���������������Ϳ����������뷴Ӧ���������Լ1��3���ͨ�뺬ˮ8%��̼�������Ʊ�Cl2O������ˮ����Cl2O�Ʊ���������Һ��
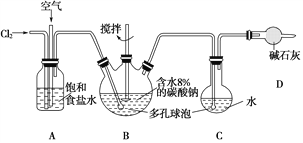
��֪��Cl2O��������ˮ����ˮ��Ӧ����HClO��Cl2O�ķе�Ϊ3.8����42�����Ϸֽ�ΪCl2��O2��
��1����ʵ���п������������������ȵķ�����___________________________________��
��ʹ�ö�����ݵ�������_____________________________________��
��2����װ��B�в���Cl2O�Ļ�ѧ����ʽΪ____________________________________��
����B����ȴװ�ã�����C�е�Cl2O��������١���ԭ����___________________________��
��3��װ��C�в�����ɫԲ����ƿ����Ϊ________________________________��
��4����֪������ɱ�H2O2��FeCl2�����ʻ�ԭ��Cl�����ⶨC�����ô�������Һ�����ʵ���Ũ�ȵ�ʵ�鷽������_________��ȡ20.00 mL��������Һ���ձ��У�_____________________________������ѡ�õ��Լ���H2O2��Һ��FeCl2��Һ��AgNO3��Һ����������������ʹ�õ������У�������ƽ����ո����䣩
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[2017����]ijС������֤��Ӧ��Fe+2Ag+=Fe2++2Ag����ʵ���м�Fe3+�����ֺ�̽���������¡�
�������ữ��0.05 mol��L-1��������Һ��pH��2���м���������ۣ�������ã��ձ��ײ��к�ɫ���壬��Һ�ʻ�ɫ��
��1���������
��ȡ��������ɫ���壬ϴ�Ӻ�_______�������������֤����ɫ�����к���Ag��
��ȡ�ϲ���Һ���μ�K3[Fe(CN)6]��Һ��������ɫ������˵����Һ�к���_______________��
��2����ԡ���Һ�ʻ�ɫ��������Ϊ��Һ����Fe3+������Ϊ���۹���ʱ��������Fe3+�������ݵ�ԭ����___________________�������ӷ���ʽ��ʾ����������ֹ۵����ʵ�飺
��ȡ�ϲ���Һ���μ�KSCN��Һ����Һ��죬֤ʵ�˼IJ²⡣ͬʱ�����а�ɫ��������������Һ��ɫ��dz��������������ȡ��ʱ���йأ��Ա�ʵ���¼���£�
��� | ȡ��ʱ��/min | ���� |
�� | 3 | ����������ɫ��������Һ�ʺ�ɫ |
�� | 30 | ������ɫ��������3 minʱ���٣���Һ��ɫ��3 minʱ���� |
�� | 120 | ������ɫ��������30 minʱ���٣���Һ��ɫ��30 minʱ��dz |
�����ϣ�Ag+��SCN-���ɰ�ɫ����AgSCN��
�� ��Fe3+������ԭ���������¼��裺
����a�����������۱����������㣬�ܲ���Fe3+��
����b�������д���O2������________�������ӷ���ʽ��ʾ�����ɲ���Fe3+��
����c��������Һ��![]() ���������ԣ��ɲ���Fe3+��
���������ԣ��ɲ���Fe3+��
����d������_______�����ж���Һ�д���Ag+���ɲ���Fe3+��
�� ����ʵ������֤ʵ����a��b��c���Dz���Fe3+����Ҫԭ��ʵ������֤ʵ����d������
ʵ�������������ữ��________��Һ��pH��2���м���������ۣ�������ã���ͬʱ��ȡ�ϲ���Һ�μ�KSCN��Һ��3 minʱ��Һ��dz��ɫ��30 min����Һ������ɫ��
ʵ������װ����ͼ�����м���Һ��________��������������________________��

��3������ʵ������Ϸ���ʽ�Ʋ�ʵ����~����Fe3+Ũ�ȱ仯��ԭ��______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com