
【题目】现有CO和CO2的混合气体,在标准状况下的体积为11.2L。请回答下列问题:
(1)该混合气体总的物质的量为_______。
(2)混合气体中碳原子的个数为___________。(用NA表示阿伏加德罗常数的值)
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。
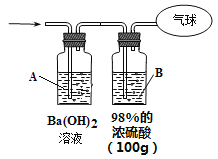
①从A瓶中获得沉淀质量的操作是_____________________称量。
②Ba(OH)2溶液浓度的测定。步骤如下:
a、过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b、将B瓶中的溶液配成1L溶液
c、将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为______________。 原Ba(OH)2溶液的浓度为___________。
③气球中收集到的气体的质量为___________。
【答案】 0.5mol 0.5NA 过滤、洗涤、干燥 0.05mol 1.5mol/L 11.2g
【解析】(1)该混合气体总的物质的量为:n=V/Vm=11.2L÷22.4Lmol-1=0.5mol。
(2)混合气体的物质的量为0.5mol,即分子数为0.5NA,因为一个CO分子中含1个C原子,一个CO2分子中含1个C原子,所以混合气体中碳原子的个数为0.5NA。
(3)①CO和CO2的混合气体通入A瓶中,CO2与Ba(OH)2反应生成BaCO3沉淀,从A瓶中获得沉淀质量的操作是:过滤、洗涤、干燥、称量。②B瓶中H2SO4的物质的量为:100g×98%÷98gmol-1=1mol,配成1L溶液后物质的量浓度为1molL-1,与A瓶中剩余的Ba(OH)2反应消耗1molL-1的H2SO4溶液50ml,根据反应:Ba(OH)2+H2SO4=BaSO4↓+H2O可得,n(BaSO4)=n(H2SO4)=1molL-1×0.05L=0.05mol;n[Ba(OH)2]=n(H2SO4)= 0.05mol,又因为吸收CO2时产生的BaCO3是19.7g,物质的量是:19.7g÷197gmol-1=0.1mol,根据Ba元素守恒,则与CO2反应的Ba(OH)2物质的量是0.1mol,所以原Ba(OH)2溶液中溶质的物质的量为:0.05mol+0.1mol=0.15mol,则原Ba(OH)2溶液的浓度为:0.15mol÷0.1L=1.5mol/L。③CO和CO2的混合气体共0.5mol,由反应CO2+Ba(OH)2=BaCO3+H2O得,n(CO2)=n(BaCO3)=0.1mol,所以CO的物质的量为:0.5mol-0.1mol=0.4mol,质量为:0.4mol×28gmol-1=11.2g。


 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案科目:高中化学 来源: 题型:
【题目】某温度下,纯水中的c(H+)=2.0×10-7mol/L,此时溶液的c(OH-)=_______mol/L;若温度不变,滴入稀盐酸使c(H+)=5.0×10-4mol/L,则溶液中c(OH-)=________mol/L,由水电离产生的c(H+)=_______mol/L,此时温度_______25℃(填“高于”、“低于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写正确的是( )
A. NaHCO3═Na++H++CO32﹣ B. NaHSO4═Na++H++SO42﹣
C. Fe2(SO4)3═Fe3++SO42﹣ D. NH3H2O═NH4++OH﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将CH3COOH溶液逐滴加入到NaOH溶液中,至溶液为中性。此时溶液中( )
A. c(CH3COO-)=c(Na+) B. c(CH3COOH)< c(Na+)
C. c(CH3COO-)>c(Na+) D. c(CH3COO-)和c(Na+)的大小无法比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素周期表中“周期”的说法错误的是
A. 元素周期表中有四个长周期、三个短周期
B. 同一周期主族元素原子的核外电子层数相同
C. 同一周期主族元素原子的价电子数目不同
D. 元素周期表中每个周期均从金属元素开始,以非金属元素结束
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的二价阳离子(R2+)核外有18个电子,质量数为42,该元素原子的原子核中的中子数为( )
A. 18 B. 20 C. 16 D. 22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【双流中学2017届下学期第二次适应性考试】某消毒液的主要成分为NaCl和NaClO,在空气中易吸收CO2而变质,且NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O。某学习小组拟探究该消毒液的变质情况。
(1)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过下列装置检验气体的成分可以判断消毒液是否变质。

学习小组研究后认为变质情况可能有三种:甲:部分变质;乙:未变质;丙:______。
为了验证可能为甲,请完成下列实验方案。限选试剂:
A.98%的浓硫酸 B.1%的品红溶液 C.1.0 mol·L-1的KI-淀粉溶液
D.1.0 mol·L-1 的NaOH溶液 e.澄清石灰水 f.饱和NaCl溶液
所加试剂 | 预期现象和结论 |
试管A中加足量______(填序号); 试管B中加1%品红溶液; 试管C中加______(填序号)。 | 若A中________, B中________, C中________,则甲成立。 |
(2)用滴定法测定消毒液中NaClO的浓度。
①在使用滴定管之前首先进行的操作是_____________________;
②量取25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液v1 mL;(反应的化学方程式为:NaClO + Na2SO3 = NaCl+ Na2SO4)将b mol·L-1的用硫酸酸化的KMnO4溶液装入_________(填仪器名称)中;滴定剩余的Na2SO3溶液,反应的化学方程式为:_______________。当溶液由__________(填滴定终点现象)停止滴定,记录数据。
③重复上述滴定操作2次,平均消耗酸性KMnO4溶液v2 mL。则消毒液中NaClO的浓度___mol·L-1(用含a、b、v1、v2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,对环境产生污染。为此,某化学兴趣小组设计了如下装置进行实验。玻璃管中①②③分别为CO检测试纸(浸有氯化钯溶液的滤纸,遇CO变黑色)、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
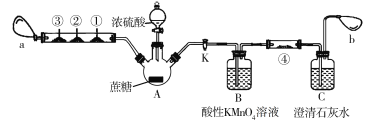
实验步骤如下:按图示连接好仪器,然后检查装置的气密性;装好试剂,夹紧止水夹K,向A瓶中的蔗糖上小心滴加浓硫酸,片刻后可观察到A瓶内蔗糖变黑,体积膨胀,有白雾产生,气球a鼓起,玻璃管中①号滤纸由白色变黑色,②号和③号滤纸均褪色。请回答以下问题:
(1)上图中盛装浓硫酸的仪器名称为________。待上述反应结束后,点燃酒精灯并在②号和③号滤纸的玻璃管附近均匀加热,观察到的现象是____________________。
(2)B瓶中酸性KMnO4溶液的作用是___________________________,发生反应的离子方程式为________________________________。
(3)打开止水夹K,使气球a内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊,但此现象并不能证明该反应生成了CO2。为了证明有CO2生成并简化实验装置,可在④号位置放上滴有__________的滤纸(从以下试剂中选择)。
A.品红溶液 B.酸性高锰酸钾溶液 C.溴水 D.澄清石灰水
(4)若反应生成的两种碳的氧化物在相同条件下的体积比为2∶1,则蔗糖炭化后体积膨胀发生反应的化学方程式可能为_______________________________。(若是氧化还原反应,请用单线桥法在化学方程式上标明电子转移的方向和数目。)
(5)若在尾端没有气球b,会有什么不良结果?______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com