
【题目】黑火药是我国古代四大发明之一,下列物质中不是黑火药主要成分的是
A. 硫磺 B. 硝酸铵 C. 硝酸钾 D. 木炭
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应:X (g) +Y (g)![]() 2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z (g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
下列说法正确的是
![]()
A. 反应前2 min的平均速率v(Z) =2.0×l0—3mol.L—l·min—l
B. 其他条件不变,降低温度,反应达到新平衡前:v(逆)>v(正)
C. 保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 moI气体Y,到达平衡时,C (Z) =0.24 mol·L—l
D. 该温度下此反应的平衡常数:K=l. 44
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有CO和CO2的混合气体,在标准状况下的体积为11.2L。请回答下列问题:
(1)该混合气体总的物质的量为_______。
(2)混合气体中碳原子的个数为___________。(用NA表示阿伏加德罗常数的值)
(3)为测定混合气体的组成,将该混合气体全部通过下图装置进行实验。经测定,A瓶中得到白色沉淀19.7g。
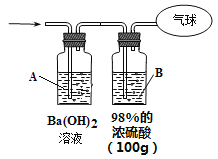
①从A瓶中获得沉淀质量的操作是_____________________称量。
②Ba(OH)2溶液浓度的测定。步骤如下:
a、过滤A溶液,得到滤液100mL(忽略溶液体积的微小变化)
b、将B瓶中的溶液配成1L溶液
c、将B瓶配制的溶液慢慢加入100mL滤液中直到不再产生沉淀。共消耗配制液50mL。
则步骤c中得到的沉淀的物质的量为______________。 原Ba(OH)2溶液的浓度为___________。
③气球中收集到的气体的质量为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. Cl 2 通入水中:Cl 2 +H 2 O == 2H+ +Cl― +ClO―
B. 用氯化铁溶液腐蚀线路板上的铜:Fe 3+ +Cu == Fe 2+ +Cu 2+
C. Al 与 NaOH 溶液反应:2Al+2OH―== 2AlO 2― +H2 ↑
D. 稀硫酸与氢氧化钡溶液混合:2H++SO42―+Ba2+ +2OH― == BaSO4 ↓+2H 2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【吉林大学附属中学2017届第八次模拟考试】麻黄素是中枢神经兴奋剂,其合成路线如图所示。NBS是一种选择性溴代试剂。

已知:![]()
(1)其中A为烃,相对分子质量为92,A的结构简式是________________;
E中官能团的名称为___________________。
(2)反应B→C的反应条件和试剂是_______________,⑤的反应类型是________。
(3)F的结构简式是____________________________。
(4)写出C→D的化学方程式______________________________________。
(5)化合物F的芳香族同分异构体有多种,M和N是其中的两类,它们的结构和性质如下:
①已知M遇FeCl3溶液发生显色反应,能和银氨溶液发生银镜反应,苯环上只有两个对位取代基,则M的结构简式可能为___________________________________。
②已知N分子中含有甲基,能发生水解反应,苯环上只有一个取代基,则N的结构有_____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是一种重要有机合成中间体,实验室可用如下反应合成:
C6H6+HNO3![]() C6H5—NO2+H2O ΔH<0
C6H5—NO2+H2O ΔH<0
已知:
①该反应在温度稍高的情况下会生成间二硝基苯。
②制备反应装置:

③有关数据如表:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 211 | 1.205 | 难溶于水 |
间二硝基苯 | 89 | 301 | 1.57 | 微溶于水 |
浓硝酸 | 83 | 1.4 | 易溶于水 | |
浓硫酸 | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)合成硝基苯的反应类型为_____________。
(2)制备时需要配制25 mL的浓硝酸和x mL(0.552 mol)浓硫酸(98%)混合液,混合酸应该盛放在_____________中(填写仪器名称),x值为_____________。
(3)反应在50℃~60℃下进行,其主要原因可能是__________________________(写两点即可),常用的方法是__________________________。
(4)反应完毕所得的硝基苯中混有无机物杂质,需将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液、水洗涤并分液,第二次用水洗的目的是__________________________。
(5)进行分液的硝基苯中含有少许水分及有机物杂质,加入无水aCl2颗粒,静置片刻,然后倒入蒸馏烧瓶,弃去CaCl2,最后进行蒸馏纯化,蒸馏纯化的实验方案为__________________________。从实验安全角度考虑,在蒸馏纯化过程中,应选用空气冷凝管,不选用通水的直形冷凝管的原因是__________________________________。
(6)若反应开始时向仪器A中加入19.5 mL苯,反应完毕提纯后得到20 g硝基苯,则实验所得到的硝基苯产率为_____________(精确到0.1%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电负性是元素原子的重要性质,研究电负性的大小及其变化规律具有重要的价值。下列几种叙述中不属于电负性的应用的是( )
A. 判断一种元素是金属还是非金属
B. 判断化合物中元素化合价的正负
C. 判断化学键的类型
D. 判断化合物的溶解度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com