
��12�֣�T ��ʱ�����ݻ�Ϊ0.5 L���ܱ������з���ijһ��Ӧ���Ҳ�ò�ͬʱ����������������A��B��C��D�����ʵ����仯��ͼ��ʾ��

��֪������A��B��C��Ϊ��̬��DΪ��̬������Ӧ�����ȷ�Ӧ������Ҫ��ش��������⣺
��1�������з�Ӧ�Ļ�ѧ����ʽΪ ��
��2��ǰ2 min��v(A)��______________ mol����min��L����1��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����___________��
A����������ѹǿ����
B�����������ܶȲ���
C������0.1mol��Bͬʱ����0.1mol��D
D��B�����ʵ�������
��4��T ��ʱ���÷�Ӧ��ƽ�ⳣ��K��_________________������С�������λ����
��5����Ӧ�ﵽƽ��ı����д�ʩ��ʹA��ת�����������________����ѡ����ĸ����
A��ֻ����A�����ʵ��� B������һ����D
C�����߷�Ӧ��ϵ���¶� D���������������Сһ��
��1��2A+B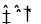 3C+D��3�֣�д��=������1�֣�
3C+D��3�֣�д��=������1�֣�
��2��0.4��2�֣�
��3��BD��2�֣���ѡ�����֣�©ѡ1����1�֣�
��4��1.69��2�֣�
��5��C��2�֣���ѡ�����֣�
��������
�����������1������������Ϣ��������ͬ��ʱ����A������0.8-0.4=0.4Ħ����B������1.0-0.8=0.2Ħ����C������0.6-0=0.6Ħ����D������0.2-0=0.2Ħ�������ʵ����ȵ��ڻ�ѧ����ʽ��ϵ���ȣ�����ABΪ��Ӧ�CDΪ���������ʽΪ��2A+B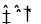 3C+D����2��A������=��0.8-0.4��/0.5/2=0.4mol����min��L����1����3��A����ӦΪǰ������������ȵķ�Ӧ������ѹǿʼ�ղ��䣬����ѹǿ���䲻��˵����Ӧ�Ѿ��ﵽƽ�⣻B�����ڷ�Ӧ���з��������ʣ����Ի��������ܶȱȲ���˵����Ӧ�ﵽƽ�⣻C������B������D����˵������Ӧ�����ʣ�����˵����Ӧ�ﵽƽ�⣻D��B�����ʵ�������˵����Ӧ�ﵽƽ�⡣����ѡBD����4��ƽ��ʱA��Ũ��Ϊ0.4/0.5=0.8mol/L��B��Ũ��.8/0.5=1.6mol/L��C��Ũ��Ϊ0.6/.05=1.2mol/L����ѧƽ�ⳣ��=c(C)3/c(A)2c(B)=1.69����5��A��ֻ����A������ƽ�������ƶ�����A��ת���ʼ�С��B������һ����D����Ӱ��ƽ�⣻C�������¶ȣ�ƽ�������ƶ���A��ת��������D���������С��ƽ�ⲻ�ƶ�������ѡC��
3C+D����2��A������=��0.8-0.4��/0.5/2=0.4mol����min��L����1����3��A����ӦΪǰ������������ȵķ�Ӧ������ѹǿʼ�ղ��䣬����ѹǿ���䲻��˵����Ӧ�Ѿ��ﵽƽ�⣻B�����ڷ�Ӧ���з��������ʣ����Ի��������ܶȱȲ���˵����Ӧ�ﵽƽ�⣻C������B������D����˵������Ӧ�����ʣ�����˵����Ӧ�ﵽƽ�⣻D��B�����ʵ�������˵����Ӧ�ﵽƽ�⡣����ѡBD����4��ƽ��ʱA��Ũ��Ϊ0.4/0.5=0.8mol/L��B��Ũ��.8/0.5=1.6mol/L��C��Ũ��Ϊ0.6/.05=1.2mol/L����ѧƽ�ⳣ��=c(C)3/c(A)2c(B)=1.69����5��A��ֻ����A������ƽ�������ƶ�����A��ת���ʼ�С��B������һ����D����Ӱ��ƽ�⣻C�������¶ȣ�ƽ�������ƶ���A��ת��������D���������С��ƽ�ⲻ�ƶ�������ѡC��
���㣺��ѧƽ�⡣


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2014-2015�㶫ʡտ���и�һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
�������ʵ���;��������Ϊ��;���������
A���������裨���ά�� B������裨�����оƬ��
C������þ���ͻ���ϣ� D��ˮ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ��һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���й���ʵ������ȡ������˵����ȷ����
A��ʢŨ����ķ�Һ©�����ó���©������
B��Ϊ�˱���ѧ���۲��������Ʊ�ʵ�飬���ڽ�̨��ֱ�����������Ʊ�ʵ��
C�����ñ���ʳ��ˮ����β��
D�����ڼ���ƿ�ڷ�һ��ʪ��ĵ��۵⻯����ֽ���۲������Ƿ��ռ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
NA��ʾ�����ӵ����������¸���������������������
A����״����11.2 L���� B��17g����
C��0.8mol���� D�����³�ѹ�£�36mL��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У��һ��ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ�뻷�������ϡ���Ϣ����Դ��ϵ���У�����˵����ȷ����
A����ɫ��ѧ�ĺ�����Ӧ�û�ѧԭ���Ի�����Ⱦ��������
B����ˮ�д��ڴ���þ����
C�������ƹ�ȼ�ϡ������������������ɼ�����������͵�������Կ�������Ⱦ
D�������оƬ�IJ����Ƕ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ��Ӧ��ʾ��ȷ����
A��Cl2ͨ��ˮ�У�Cl2+H2O=2H+ +Cl-+ClO-
B���ö��Ե缫��ⱥ��NaCl��Һ�� 2H++2Cl- Cl2��+H2��
Cl2��+H2��
C����ʯī���缫���CuSO4��Һ��2Cu2++2H2O 2Cu+O2��+4H+
2Cu+O2��+4H+
D����������������ʴʱ������ӦΪ��Fe - 3e- = Fe3+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015����ʡ�����з�һ�����У�߶���ѧ����ĩ��ѧ�Ծ��������棩 ���ͣ�ѡ����
���и��������ܴ���������ͬһ��Һ�е���
A��Ba2+��Mg2+��Cl-��CO32-
B��Fe3+��K+��I-��SO42-
C��K+��NH4+��NO3����OH��
D��Al3+��NH4+��NO3����Cl��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015�����з�̨����һ��ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ�Ҳ���ǰ�Ƶ�һ�����ͷ���O4��2 mol O4��4 mol O2 ���е�
A����������ͬ����������ͬ B��������ͬ����������ͬ
C��ԭ������ͬ����������ͬ D����������ͬ��������ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014-2015ѧ���㽭ʡ������ѧ�ڵ�����ͳ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��14�֣�CO2��Ϊδ��̼Դ���ȿ��ֲ���ʯ�͡���Ȼ���ȴ�����������ġ�̼ԴΣ�������ֿ���Ч�ؽ������ЧӦ����ش��������⣺
��1��������CH4��H2O(g)ͨ��۽�̫���ܷ�Ӧ����������ӦCH4(g)+H2O(g) CO(g)+3H2(g) ��H = +206 kJ��mol-1���������ʵ�����CH4��H2O(g)����2 L�����ܱ�������ij�¶��·�Ӧ5 min��ﵽƽ�⣬��ʱ���CO�����ʵ���Ϊ0.10 mol����5 min��H2��ƽ����Ӧ����Ϊ ��ƽ�����Բ�ȡ���� �Ĵ�ʩ��ʹn��CO����n��CH4������
CO(g)+3H2(g) ��H = +206 kJ��mol-1���������ʵ�����CH4��H2O(g)����2 L�����ܱ�������ij�¶��·�Ӧ5 min��ﵽƽ�⣬��ʱ���CO�����ʵ���Ϊ0.10 mol����5 min��H2��ƽ����Ӧ����Ϊ ��ƽ�����Բ�ȡ���� �Ĵ�ʩ��ʹn��CO����n��CH4������
A�����������¶�
B�����º����³��뺤��
C�������������������
D�����º������ٳ�������ʵ�����CH4��H2O
��2����ҵ�Ͽ�������COΪԭ����ȡCH3OH��
��֪:CO2(g)+3H2(g) CH3OH(g) +H2O(g) ��H=-49.5 kJ��mol��1
CH3OH(g) +H2O(g) ��H=-49.5 kJ��mol��1
CO2��g��+H2��g�� CO��g��+H2O��g�� ��H= + 41.3 kJ��mol��1
CO��g��+H2O��g�� ��H= + 41.3 kJ��mol��1
����д����CO��H2��ȡ�״����Ȼ�ѧ����ʽ ��
�ڸ÷�Ӧ�ġ�S 0(�>����<����=��)���� ����������ڸ÷�Ӧ�Է����С�
��3��ij������ԱΪ�о�H2��CO�ϳ�CH3OH�������ʼ��ɱ�n(H2) �� n(CO)����l L�����ܱ�������ͨ��H2��CO�Ļ������CO��Ͷ������Ϊ1 mol�����ֱ���230��C��250��C��270��C����ʵ�飬��ý������ͼ����230��ʱ��ʵ��������Ӧ�������� (����ĸ)�������� ����ʽ����270��ʱ�÷�Ӧ��ƽ�ⳣ��K�� ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com