
����Ŀ����Ȼ����һ����Ҫ�������Դ�ͻ���ԭ�ϣ�����Ҫ�ɷ�Ϊ���顣
��1����ҵ�Ͽ���ú����Ȼ���������������ж���;������CH4��
д��CO��H2��Ӧ����CH4��H2O���Ȼ�ѧ����ʽ____________
��֪�� CO(g)+H2O(g)![]() H2(g)+CO2(g) ��H����41kJ��mol��1
H2(g)+CO2(g) ��H����41kJ��mol��1
C(s)+2H2(g)![]() CH4(g) ��H����73kJ��mol��1
CH4(g) ��H����73kJ��mol��1
2CO(g)![]() C(s)+CO2(g) ��H����171kJ��mol��1
C(s)+CO2(g) ��H����171kJ��mol��1
��2����Ȼ���е�H2S���ʳ��ð�ˮ���գ�����ΪNH4HS��һ����������NH4HS��Һ��
ͨ��������õ�������ʹ����Һ������д��������Ӧ�Ļ�ѧ����ʽ____________��
��3����Ȼ����һ����Ҫ��;����ȡH2����ԭ��Ϊ��CO2(g)��CH4(g)![]() 2CO(g)��2H2(g)�����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L��1��CH4��CO2����һ�������·�����Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ1��ʾ����ѹǿP1_________P2������ڡ���С�ڡ�����ѹǿΪP2ʱ����Y�㣺v(��)___________v(��)������ڡ�����С�ڡ����ڡ����� ��Y���Ӧ�¶��µĸ÷�Ӧ��ƽ�ⳣ��K=__________����������������λ��Ч���֣�
2CO(g)��2H2(g)�����ܱ�������ͨ�����ʵ���Ũ�Ⱦ�Ϊ0.1mol��L��1��CH4��CO2����һ�������·�����Ӧ�����CH4��ƽ��ת�������¶ȼ�ѹǿ�Ĺ�ϵ����ͼ1��ʾ����ѹǿP1_________P2������ڡ���С�ڡ�����ѹǿΪP2ʱ����Y�㣺v(��)___________v(��)������ڡ�����С�ڡ����ڡ����� ��Y���Ӧ�¶��µĸ÷�Ӧ��ƽ�ⳣ��K=__________����������������λ��Ч���֣�

��4���Զ������ѱ��渲��CuAl2O4Ϊ���������Խ�CH4��CO2ֱ��ת�������ᡣ
���ڲ�ͬ�¶��´����Ĵ�Ч�������������������ͼ2��ʾ��250~300��ʱ���¶����߶�������������ʽ��͵�ԭ����________________��
��Ϊ����߸÷�Ӧ��CH4��ת���ʣ����Բ�ȡ�Ĵ�ʩ��________________��
���𰸡�CO (g)+3H2(g)![]() CH4(g)+ H2O(g) ��H����203kJ��mol��1 2NH4HS��O2��2NH3��H2O��2S�� С�� ���� 1.6mol2/L2 �¶ȳ���250oCʱ�������Ĵ�Ч�ʽ��� ����Ӧѹǿ������CO2��Ũ��
CH4(g)+ H2O(g) ��H����203kJ��mol��1 2NH4HS��O2��2NH3��H2O��2S�� С�� ���� 1.6mol2/L2 �¶ȳ���250oCʱ�������Ĵ�Ч�ʽ��� ����Ӧѹǿ������CO2��Ũ��
��������
��1�����ݸ�˹���ɣ�CO��H2��Ӧ����CH4��H2O���Ȼ�ѧ����ʽΪCO (g) + 3H2(g)![]() CH4(g) + H2O(g) ��H����203kJ��mol��1���ʴ�ΪCO (g) + 3H2(g)
CH4(g) + H2O(g) ��H����203kJ��mol��1���ʴ�ΪCO (g) + 3H2(g)![]() CH4(g) + H2O(g) ��H����203kJ��mol��1��
CH4(g) + H2O(g) ��H����203kJ��mol��1��
��2��һ����������NH4HS��Һ��ͨ�������NH4HS�ܹ�������е�������Ӧ�õ�������Ӷ�ʹ����Һ�������仯ѧ����ʽΪ2NH4HS��O2��2NH3��H2O��2S�����ʴ�Ϊ2NH4HS��O2��2NH3��H2O��2S����
��3����ӦCO2(g)��CH4(g)![]() 2CO(g)��2H2(g)��һ���������������ķ�Ӧ������ѹǿ����ѧƽ���������������С��������У�ƽ��ת���ʼ�С����ͬ�������£�ѹǿP1ʱ��ת���ʴ���ѹǿP2ʱ��ת���ʣ����ѹǿP1С��P2��ѹǿΪP2ʱ����Y�㣬���ڻ�δ�ﵽƽ��״̬����Ӧһֱ����������ţ����v(��)����v(��)����ͼ1��֪����Y���Ӧ�¶��£��÷�Ӧƽ��ת����Ϊ0.8����ѧƽ�ⳣ���ļ������������
2CO(g)��2H2(g)��һ���������������ķ�Ӧ������ѹǿ����ѧƽ���������������С��������У�ƽ��ת���ʼ�С����ͬ�������£�ѹǿP1ʱ��ת���ʴ���ѹǿP2ʱ��ת���ʣ����ѹǿP1С��P2��ѹǿΪP2ʱ����Y�㣬���ڻ�δ�ﵽƽ��״̬����Ӧһֱ����������ţ����v(��)����v(��)����ͼ1��֪����Y���Ӧ�¶��£��÷�Ӧƽ��ת����Ϊ0.8����ѧƽ�ⳣ���ļ������������
CO2(g)��CH4(g)![]() 2CO(g)��2H2(g)
2CO(g)��2H2(g)
��ʼŨ�ȣ�mol/L�� 0.1 0.1 0 0
ת��Ũ�ȣ�mol/L�� 0.08 0.08 0.16 0.16
ƽ��Ũ�ȣ�mol/L�� 0.02 0.02 0.16 0.16
ƽ�ⳣ��K= ![]() mol2/L2��
mol2/L2��
�ʴ�ΪС����������1.6mol2/L2��
��4���ٸ���ͼ��250~300��ʱ���¶����߶�������������ʽ��͵�ԭ�����¶ȳ���250��ʱ�������Ĵ�Ч�ʽ��ͣ��ʴ�Ϊ�¶ȳ���250oCʱ�������Ĵ�Ч�ʽ�����
��CH4��CO2ת��Ϊ����ķ�Ӧ�ɱ�ʾΪCH4+CO2![]() CH3COOH�����ڷ�Ӧ�Ħ�Hδ֪�����Ϊ�����CH4��ת���ʣ���������Ӧѹǿ������CO2��Ũ�ȵķ�ʽ�����CH4��ת���ʡ��ʴ�Ϊ����Ӧѹǿ������CO2��Ũ����
CH3COOH�����ڷ�Ӧ�Ħ�Hδ֪�����Ϊ�����CH4��ת���ʣ���������Ӧѹǿ������CO2��Ũ�ȵķ�ʽ�����CH4��ת���ʡ��ʴ�Ϊ����Ӧѹǿ������CO2��Ũ����


 ������ϰ�ο����뵥Ԫ���ϵ�д�
������ϰ�ο����뵥Ԫ���ϵ�д� �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ�ҿ�����һ�֡����ᷰ�/ʯī���ӵ�ء���4.6V��λ������ܷ�ӦΪ��Li3C6��V2(PO4)3![]() 6C��Li3V2(PO4)3�������й�˵����ȷ����
6C��Li3V2(PO4)3�������й�˵����ȷ����
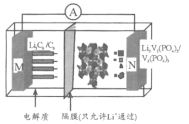
A.�õ�ر������ߣ���Li3V2(PO4)3����������
B.�ŵ�ʱ�����·��ͨ��0.1 mol����M����������0.7 g
C.���ʱ��Li+��N����Ǩ��
D.���ʱ��N����ӦΪV2(PO4)3��3Li����3e��=Li3V2(PO4)3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��O2��HClת��ΪCl2�������Ч�棬������Ⱦ.��ͳ�ϸ�ת��ͨ����ͼ��ʾ�Ĵ���ѭ��ʵ�֣����У���Ӧ��Ϊ 2HCl(g)+CuO(s)=H2O(g)+CuCl2(s) ![]() ��Ӧ������1molCl2(g)�ķ�Ӧ��Ϊ
��Ӧ������1molCl2(g)�ķ�Ӧ��Ϊ![]() �����ܷ�Ӧ���Ȼ�ѧ����ʽΪ_______________(��Ӧ�ȡ�H�ú�
�����ܷ�Ӧ���Ȼ�ѧ����ʽΪ_______________(��Ӧ�ȡ�H�ú�![]() ��
��![]() �Ĵ���ʽ��ʾ)��
�Ĵ���ʽ��ʾ)��
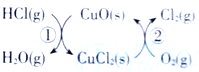
(2)���ݻ�Ϊ1L���ܱ������У�ͨ��һ������N2O4��������ӦN2O4(g) 2NO2(g)�����¶����ߣ�����������ɫ����ش��������⣺
���÷�Ӧ��![]() ____________0���>����<������100��ʱ����ϵ�и�����Ũ����ʱ��仯���±���ʾ����0��60sʱ�Σ���Ӧ������(N2O4)Ϊ_________mol��L-1��s-1��40sʱC2___________0.10mol/L���>����<������
____________0���>����<������100��ʱ����ϵ�и�����Ũ����ʱ��仯���±���ʾ����0��60sʱ�Σ���Ӧ������(N2O4)Ϊ_________mol��L-1��s-1��40sʱC2___________0.10mol/L���>����<������
��100��ʱ��ƽ��ı䷴Ӧ�¶�Ϊ![]() ��c(N2O4)��0.0020 mol��L
��c(N2O4)��0.0020 mol��L![]() ��s
��s![]() ��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⡣��T______100�棨�>����<������
��ƽ�����ʽ��ͣ���10s�ִﵽƽ�⡣��T______100�棨�>����<������
�������¶�Tʱ��Ӧ��ƽ�ⳣ��K___________��
(3)�¶�Tʱ��Ӧ��ƽ�����Ӧ�������ݻ�����һ�롣ƽ����___________�������Ӧ�����淴Ӧ���������ƶ���N2O4��ת����______�������С������
ʱ�䣨s�� | 0 | 20 | 40 | 60 | 80 |
N2O4Ũ�� ��mol/L) | 0.10 | 0.06 | C1 | 0.04 | 0.04 |
NO2Ũ�� ��mol/L) | 0 | 0.08 | C2 | 0.12 | 0.12 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�ʾʽ�������(����)
A. Na���Ĺ����ʾʽ��![]() B. Na���Ľṹʾ��ͼ��
B. Na���Ľṹʾ��ͼ��![]()
C. Na�ĵ����Ų�ʽ��1s22s22p63s1 D. Na����Χ�����Ų�ʽ��3s1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ����ӵ�����ԭ���ӻ������������ͬ���ǣ� ��
A.SO32-��SO3B.CH4��H2OC.NCl3��BF3D.SO32-��CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��COS(g)+H2(g)![]() H2S(g)+CO(g) ��H1=+7 kJ/mol
H2S(g)+CO(g) ��H1=+7 kJ/mol
COS(g)+H2O(g)![]() H2S (g)+CO2(g) ��H2=-35 kJ/mol
H2S (g)+CO2(g) ��H2=-35 kJ/mol
���Ȼ�ѧ����ʽ��CO(g)+H2O (g)![]() H2(g)+CO2(g) ��H3������H3Ϊ
H2(g)+CO2(g) ��H3������H3Ϊ
A.-42kJ/molB.-28kJ/molC.+42kJ/molD.+28kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͨ����ԭ�������ͼ۵���������ͬ�ķ��ӻ����ӳ�Ϊ�ȵ����壬�ȵ�����������ƵĻ�ѧ�ṹ���������й�˵������ȷ���ǣ� ��
A.CH4��NH4+�ǵȵ����壬��ѧ��������ȫ��ͬ
B.NO3-��CO32-�ǵȵ����壬��Ϊƽ���������νṹ
C.H3O+��PCl3�ǵȵ����壬��Ϊ�����νṹ
D.SO2��O3�ǵȵ����壬SO2��O3������ͬ�Ļ�ѧ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��M��N��R���ǵ�����������Ԫ�ء�25��ʱ����Ԫ������������Ӧˮ����� pH ��ԭ�Ӱ뾶�Ĺ�ϵ��ͼ������ X��N��W��R �ⶨ����Ũ�Ⱦ�Ϊ0.01 mol/L��Һ��pH��Y��Z�ⶨ�����䱥����Һ��pH������˵����ȷ����

A.R��N�ֱ���X�γɶ�Ԫ�������ˮ��Һ���ʼ���
B.N��Z��X����Ԫ�ص���������������ˮ��Ӧ
C.������ H2���������ѵ�˳���ǣ�R��N��M
D.������������ˮ��Ӧ�����ѵ�˳���ǣ�Y��X��Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���з�Ӧ���Ȼ�ѧ����ʽ��
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l)��H1
2 H2(g)+ O2(g)= 2H2O(g)��H2
C(s)+ O2(g)=CO2(g)��H3
��Ӧ4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)����HΪ
A. 12��H3+5��H2-2��H1 B. 2��H1-5��H2-12��H3
C. 12��H3-5��H2-2��H1 D. ��H1-5��H2-12��H3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com