
【题目】水的电离平衡曲线如右图所示,下列说法中,正确的是
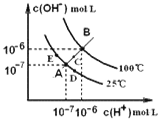
A. 图中A、B、D三点处KW间的关系: B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C. 温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D. 加热浓缩A点所示溶液,可从A点变化到B点
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )

A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25 ℃时0.1 mol·L-1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中![]() ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:__________;所得溶液的pH________7(填“>”、“<”或“=”),用离子方程式表示其原因:__________;所得溶液中各离子物质的量浓度由大到小的顺序是____________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH![]() )=a moL.L-1,则c(SO42-)为________。
)=a moL.L-1,则c(SO42-)为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用两根金属铂做电极,以KOH溶液做电解质溶液,从两极分别通入CH4(g)和O2,则对该燃料电池的下列叙述中正确的是 ( )
A. 负极的电极反应式为:CH4—8e-+10OH-=CO32-+7H2O
B. 负极的电极反应式为:4OH--4e-=2H2O+O2↑
C. 标准状况下,通入5.6 LO2并完全反应后,有2.00mol电子转移
D. 放电一段时间后,通入O2的电极附近溶液的pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
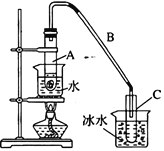
【题目】某化学小组采用类似制乙酸乙酯的装置(如右图所示),用环己醇制备环己烯。
已知: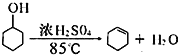
相对分子质量 | 密度/g cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5 mL环己醇与1mL浓硫酸加入试管A中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①在试管中混合环已醇和浓硫酸操作时,加入药品的先后顺序为_________。
②如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_________(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③将试管C置于冰水中的目的是_______________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。向粗品中加入饱和食盐水,振荡、静置、分层,环己烯在__________________层(填“上”或“下”),分液后用__________________(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
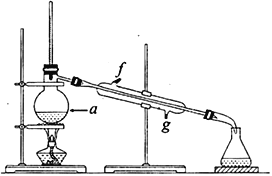
②再将提纯后的环己烯按如图所示装置进行蒸馏。图中仪器a 的名称是_______________。实验中冷却水从__________(填字母)口进入。蒸馏时要加入生石灰,目的是__________________________。
(3)若在制备粗品时环已醇随产品一起蒸出,则实验制得的环己烯精品质量__________(填“高于”、“ 低于”)理论产量。本实验所得到的环已烯质量为6.25g,则产率是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保部门每天通过新闻媒体向社会发布以污染物浓度为标准确定空气质量的信息.这些污染物是( )
A.二氧化硫、氮氧化物、悬浮微粒
B.二氧化硫、氮氧化物、一氧化碳
C.三氧化硫、氮氧化物、悬浮微粒
D.稀有气体、氮氧化物、悬浮微粒
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com