
【题目】化学与我们的生活息息相关,化学的丰富多彩从而导致我们的生活也多姿多彩。
(1)中国的瓷器名世界,制备陶瓷是以粘土[主要成分 Al2Si2O5(OH)4]为原料,经过高温烧结而成,若以氧化物形式表示该粘土的组成,则应表示为________________________。
(2)硅元素为亲氧元素,其在自然界通常以化合态形式存在,而单质硅是一种重要的半导体材料,在工业上常在高温下用C还原SiO2来制取,请写出该反应的化学方程式_________________________________。
(3)新制的氯水通入适量的SO2可以看到氯水颜色褪去,请写出此时导致颜色褪去的化学方程________。
(4)新制备的氢氧化亚铁为白色固体,在空气中会迅速变灰绿色最后变成红褐色,请写出氢氧化亚铁固体在空气中发生变化的化学方程式_______________________________________________。
(5)金属铜与浓、稀硝酸的反应可以分别用于实验室制取NO或NO2气体,请写出实验室利用铜与稀硝酸反应制取NO的离子方程式___________________________________________________。
【答案】Al2O3·2SiO2·2H2O SiO2+2C![]() Si+2CO↑ SO2+Cl2+2H2O=H2SO4+2HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
Si+2CO↑ SO2+Cl2+2H2O=H2SO4+2HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
【解析】
(1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序来书写,并要遵守原子守恒来分析解答;
(2)C还原SiO2生成CO和单质硅,据此书写;
(3)二氧化硫与氯气发生氧化还原反应,导致氯水褪色;
(4)氢氧化亚铁和氧气、水反应生成氢氧化铁;
(5)Cu和稀硝酸发生氧化还原反应生成硝酸铜、NO和水。
(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物、较活泼金属氧化物、SiO2、H2O的顺序可知,Al2Si2O5(OH)4可改成Al2O3·2SiO2·2H2O;
(2)工业常用高温下C还原SiO2来制取硅,Si元素化合价降低,生成硅单质,被还原,C元素化合价升高,被氧化,生成一氧化碳,反应方程式为SiO2+2C![]() Si+2CO↑;
Si+2CO↑;
(3)二氧化硫具有还原性,能被氯水氧化,氯水褪色,反应的化学方程式为SO2+Cl2+2H2O=H2SO4+2HCl;
(4)氢氧化亚铁和氧气、水反应生成氢氧化铁,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(5)硝酸具有强氧化性,能和较不活泼的金属Cu反应生成硝酸铜、NO和水,离子方程式为3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】已知有下图所示物质相互转换关系

试回答:
(1)写出B的化学式__________,D的化学式__________;
(2)写出由E转变成F的化学方程式__________;
(3)向G溶液中加入A的离子方程式__________;
向G溶液中加入铜片的离子方程式__________;
(4)简述B溶液中阳离子的检验方法__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:i.Fe3+ 在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;
[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O![]() [Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
ii.[FeCl4(H2O)2]-为黄色。
【实验I】

【实验II】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。


图1 图2
Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验I中,试管②溶液变为无色的原因是 。
(2)实验I中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是 。
(3)由实验II图1、2可知:加热时,溶液颜色 (填“变浅”、“变深”或“不变”)。
(4)由实验II,可以得出如下结论:
[结论一]FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O![]() [Fe(H2O)6]3++4Cl-
[Fe(H2O)6]3++4Cl-
得出此结论的理由是 。
[结论二] 结论一中反应的ΔH (填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液, (请描述必要的实验操作和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅单质及其化合物在新能源领域应用广泛,工业上利用方铅精矿(主要成分为PbS)制备PbSO4的工艺流程如下:
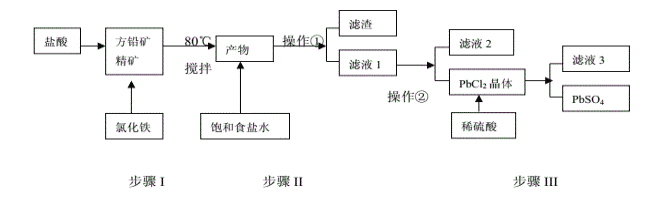
已知:①PbCl2(s)+2Cl-(aq)![]() PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
PbCl4-(aq) △H>0 ②Ksp(PbSO4)=1.0×10-8,Ksp(PbCl2)=1.6×10-5③Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH值分别为3.2、7.0。
(1)步骤Ⅰ中发现有淡黄色沉淀生成,请写出离子反应方程式:_______________________;
(2)步骤Ⅰ原料预处理过程中写出一种除搅拌外加快反应速率的办法:_________________;反应温度不宜过高,且需加入过量盐酸保证溶液呈强酸性,原因是:____________________;
(3)操作①应为:_______ ;操作②应为:_________ ;
A、趁热过滤 B、蒸发浓缩,冷却结晶; C、蒸发结晶 D、重结晶
(4)写出步骤III中PbCl2生成PbSO4的离子反应方程式:___________________________ ,该反应的平衡常数K=_______;
(5)铅蓄电池(Pb-PbO2-H2SO4)充电时的阳极反应方程式:_________________________ ;
(6)某铅蓄电池放电时电流为0.2A,可持续放电时间96500s,此时参加反应的Pb的质量为41.4g,求该电池放电的能量转化率α=_________ 。(电池能量转化率的定义:α=实际输出电量/理论输出电量×100%,结果保留两位有效数字,已知法拉第常数为96500C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10mol·L-1盐酸滴入20.00 mL 0.10mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列说法正确的是

A. M点所示溶液中c(NH4+)+c(NH3·H2O)=c(Cl-)
B. N点所示溶液中c(NH4+)>c(Cl-)
C. Q点消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2及(NH4)4[UO2(CO3)3]等。
回答下列问题:
(1)UF4用Mg或Ca还原可得金属铀。与钙同周期基态原子的未成对电子数为2的元素共有___种;原子序数为镁元素的二倍的元素的基态原子价电子排布图为_______。
(2)已知:2UO2+5NH4HF2![]() 2UF4·NH4F+3NH3↑+4H2O↑
2UF4·NH4F+3NH3↑+4H2O↑
HF2-的结构为[F-H…F]-
①NH4HF2中含有的化学键有__ (填选项字母)。
A.氢键 B.配位键 C.共价键 D.离子键 E.金属键
②与氧同周期,且第一电离能比氧大的元素有______种。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑
①写出与NH4+互为等电子体的一种分子和一种离子的化学式______、_______。
②物质 中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
中与CO32-的碳原子杂化类型相同和不同的碳原子的个数比为______。
③分解所得的气态化合物的分子键角由小到大的顺序为__ (填化学式)
(4)C元素与N元素形成的某种晶体的晶胞如图所示(8个碳原子位于立方体的顶点,4个碳原子位于立方体的面心,4个氮原子在立方体内),该晶体硬度超过金刚石,成为首屈一指的超硬新材料。

①晶胞中C原子的配位数为______。该晶体硬度超过金刚石的原因是_________。
②已知该晶胞的密度为dg/cm3,N原子的半径为r1cm,C原子的半径为r2cm,设NA为阿伏加德罗常数,则该晶胞的空间利用率为_______(用含d、r1、r2、NA的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据实验操作及现象得出的结论正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向亚硫酸钠试样中滴入盐酸酸化的Ba(C1O)2 溶液 | 产生白色沉淀 | 试样已氧化变质 |
B | 向Co2O3中滴入浓盐酸 | 产生黄绿色气体 | 氧化性:Co2O3 > C12 |
C | 向待测液中依次滴入氯水和KSCN 溶液 | 溶液变为红色 | 待测液中含有Fe2+ |
D | 向NaHCO3溶液中滴加NaAlO2溶液 | 有白色沉淀和气体产生 | AlO2-与HCO3-发生了双水解反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100kPa时,反应2NO(g)+O2(g)![]() 2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)
2NO2(g)中NO的平衡转化率与温度的关系曲线如图1,反应2NO2(g)![]() N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
N2O4(g)中NO2的平衡转化率与温度的关系曲线如图2。
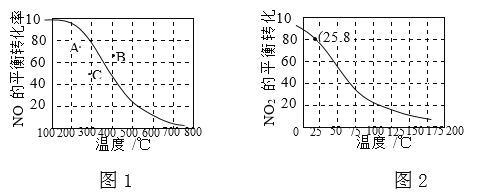
① 图1中A、B、C三点表示不同温度、压强下2NO(g)+O2(g)![]() 2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
2NO2(g)达到平衡时NO的转化率,则________点对应的压强最大。
② 100kPa、25℃时,2NO2(g)![]() N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
N2O4(g)平衡体系中,列式计算平衡常数Kp=________。(Kp用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奶粉中蛋白质含量的测定往往采用“凯氏定氮法”,其原理是食品与硫酸和催化剂一同加热,使蛋白质分解,分解的氨与硫酸结合生成硫酸铵。然后碱化蒸馏使氨游离,用硼酸吸收后再以硫酸或盐酸标准溶液滴定,根据酸的消耗量乘以换算系数,即为蛋白质含量。
操作步骤:
①样品处理:准确称取一定量的固体样品奶粉,移入干燥的烧杯中,经过一系列的处理,待冷却后移入一定体积的容量瓶中。
②NH3的蒸馏和吸收:把制得的溶液(取一定量),通过定氮装置,经过一系列的反应,使氨变成硫酸铵,再经过碱化蒸馏后,氨即成为游离态,游离氨经硼酸吸收。
③氨的滴定:用标准盐酸溶液滴定所生成的硼酸铵,由消耗的盐酸标准液计算出总氮量,再折算为粗蛋白含量。
请回答下列问题:
(1)在样品的处理过程中使用到了容量瓶,怎样检查容量瓶是否漏水_________。
(2)在配制过程中,下列哪项操作可能使配制的溶液的浓度偏大_______。
A.烧杯中溶液转移到容量瓶中时,未洗涤烧杯 B.定容时,俯视刻度线
C.定容时,仰视刻度线 D.移液时,有少量液体溅出
(3)若称取样品的质量为1.5g,共配制100mL的溶液,取其中的20mL,经过一系列处理后,使N转变为硼酸铵然后用0.1mol·L-1盐酸滴定,其用去盐酸的体积为23.0mL,则该样品中N的含量为________。
(滴定过程中涉及到的反应方程式:(NH4)2B4O7+2HCl+5H2O=2NH4Cl+4H3BO3)
(4)一些不法奶农利用“凯氏定氮法”只检测氮元素的含量而得出蛋白质的含量这个检测法的缺点,以便牛奶检测时蛋白质的含量达标,而往牛奶中添加三聚氰胺(C3N6H6)。则三聚氰胺中氮的含量为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com