
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离饱和食盐水与沙子的混合物 ;
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾 ;
(3)分离水和汽油的混合物 ;
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体 ;
(5)从碘水中提取碘单质 .
| 物质分离和提纯的方法和基本操作综合应用.. | |
| 专题: | 化学实验基本操作. |
| 分析: | (1)不溶物与液体的分离; (2)可溶性固体之间的分离,且二者的溶解度受温度的影响不同; (3)二者不互溶,分层; (4)二者互溶,但沸点不同,利用沸点的差异来分离; (5)碘在水中的溶解度比在有机物中的溶解度小,选择萃取剂来分离. |
| 解答: | 解:(1)饱和食盐水与沙子的混合物为不溶物与液体的分离,可利用过滤法分离,故答案为:F; (2)从硝酸钾和氯化钠的混合液中获得硝酸钾为可溶性固体之间的分离,且二者的溶解度受温度的影响不同,可利用结晶法分离,故答案为:C; (3)水和汽油二者不互溶,分层,可利用分液法分离,故答案为:D; (4)酒精和甲苯二者互溶,但沸点不同,利用沸点的差异来分离,即采用蒸馏法分离,故答案为:E; (5)碘在水中的溶解度比在有机物中的溶解度小,选择萃取剂来分离,即选择萃取分液法分离,故答案为:A. |
| 点评: | 本题考查混合物的分离方法,熟悉常见的混合物分离的方法及使用条件即可解答,题目较简单. |


科目:高中化学 来源: 题型:
一定能在下列溶液中大量共存的离子组是
①含有大量Al3+的溶液中:Na+、NH4+、SO42—、Cl-
②加入Al能放出H2的溶液中:Cl-、HCO3—、SO42—、NH4+
③含有大量Fe3+的溶液中:Na+、Mg2+、NO3—、SCN-
④在含有大量AlO2—的溶液中:NH4+、Na+、Cl-、H+
⑤由水电离出的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO3—
A.①② B.①③⑤ C.① D.①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H= + 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
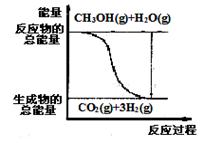 下列说法正确的是( )
下列说法正确的是( )
A.②中CH3OH的反应热为192.9 kJ·mol-1
B.反应①中的能量变化如右图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应: CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的 △H>-192.9kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶无色溶液加以区别的一种试剂是(必要时可加热)( )
|
| A. | BaCl2 | B. | NaOH | C. | Ba(OH)2 | D. | AgNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是( )
|
| A. | Cu+4 HNO3(浓)═Cu(NO3)2+2 NO2↑+2 H2O |
|
| B. | 3O2═2O3、 |
|
| C. | HCl+NaHCO3=NaCl+H2O+CO2 |
|
| D. | CuCl2+2NaOH=Cu(OH)2+2NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。
已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-发生转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施对增大反应速率明显有效的是
A.在炭粉燃烧中加入KClO3
B.Zn与25%的稀硫酸反应制取H2时,改用98%的浓硫酸
C.在K2S04与BaCl2两溶液反应时,增大压强
D.Na与乙醇反应时增大乙醇的用量
查看答案和解析>>
科目:高中化学 来源: 题型:
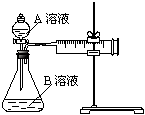 教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
| ② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
 ⑴写出草酸溶于水的电离方程式: 。
⑴写出草酸溶于水的电离方程式: 。
⑵该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是:① ②(填:>、<、=)。
⑶若实验①在2 min末收集了4.48 mL CO2(标准状况下),则
在2 min末, c(MnO4-)= mol/L。
⑷除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
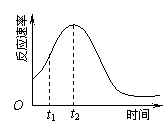
⑸小组同学发现反应速率随时间变化如上图所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热,② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com