
下列反应属于氧化还原反应的是( )
|
| A. | Cu+4 HNO3(浓)═Cu(NO3)2+2 NO2↑+2 H2O |
|
| B. | 3O2═2O3、 |
|
| C. | HCl+NaHCO3=NaCl+H2O+CO2 |
|
| D. | CuCl2+2NaOH=Cu(OH)2+2NaCl |
| 氧化还原反应.. | |
| 专题: | 氧化还原反应专题. |
| 分析: | 氧化还原反应的特征是元素化合价的升降,当有化合价发生变化时,一定属于氧化还原反应,结合题中反应方程式解答该题. |
| 解答: | 解:A.Cu+4 HNO3(浓)═Cu(NO3)2+2 NO2↑+2 H2O中Cu元素的化合价升高,N元素的化合价降低,属于氧化还原反应,故A正确; B.3O2═2O3反应物与生成物的化合价均为0,没有元素化合价的变化,不是氧化还原反应,故B错误; C.HCl+NaHCO3=NaCl+H2O+CO2中没有元素化合价的变化,不是氧化还原反应,故C错误; D.CuCl2+2NaOH=Cu(OH)2+2NaCl中没有元素化合价的变化,不是氧化还原反应,故D错误; 故选A. |
| 点评: | 本题考查氧化还原反应,侧重于学生的分析能力和基本概念的理解和运用的考查,注意根据反应中元素的化合价来分析判断,题目难度不大. |


科目:高中化学 来源: 题型:
下列叙述正确的是 ( )
A、元素处于最高价态时一定有强氧化性;同理元素处于最低价态时一定具有强还原性。
B、将FeCl2溶液与稀HNO3混合离子反应方程式:Fe2++4H++NO ===Fe3++NO↑+2H2O
===Fe3++NO↑+2H2O
C、HF、Al(OH)3、氨水都是弱电解质
D、颜色反应、显色反应、指示剂变色反应均属化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
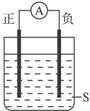
如右图所示装置,电流计的指针发生偏转,正极变粗,负极变细,符合这种情况的是
A.正极Cu,负极Al,S为浓HNO3
B.正极Ag,负极Fe,S为CuSO4
C.正极Al,负极Cu,S为浓HNO3
D.正极Zn,负极Cu,S为CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
|
| A. | 含有NA个氦原子的氦气在标准状况下的体积约为11.2L |
|
| B. | 常温常压下,11.2L氧气所含的原子数为NA |
|
| C. | 标准状况下,11.2L H2O 含有的分子数为0.5NA |
|
| D. | 常温常压下,44g CO2含有的原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
选择下列实验方法分离物质,将分离方法的序号填在横线上.
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
(1)分离饱和食盐水与沙子的混合物 ;
(2)从硝酸钾和氯化钠的混合液中获得硝酸钾 ;
(3)分离水和汽油的混合物 ;
(4)分离酒精(沸点为78.1℃)和甲苯(沸点为110.6℃)两种互溶液体 ;
(5)从碘水中提取碘单质 .
查看答案和解析>>
科目:高中化学 来源: 题型:
从海带中提取碘的实验过程中,涉及到下列操作,其中正确的是(考察每一个操作时,假设其它操作均正确)( )
|
|
|
|
|
A.将海带灼烧成灰 B.过滤得合I—溶液 C.放出碘的苯溶液 D.分离碘并回收苯
查看答案和解析>>
科目:高中化学 来源: 题型:
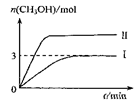
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究。在T10C 时,将9molCO2和12molH2充入3L密闭容器中,发生反应CO2(g)+3H2(g) 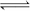 CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如右图曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如右图曲线II所示。下列说法正确的是
CH3OH(g)+H2O(g) ΔH <0,容器中CH3OH的物质的量随时间变化如右图曲线I所示,平衡时容器内压强为P。改变某一条件重新进行上述反应,CH3OH的物质的量随时间变化如右图曲线II所示。下列说法正确的是
A.曲线II对应的条件改变是减小压强
B.若T2°C时,上述反应平衡常数为0.42,则T2< T1
C.在T10C时,若起始时向容器中充入5 mol CO2、5 mol H2、5 mol CH3OH(g)和 5 mol H2O(g),则达平衡前v(正)>v(逆)
D.在T10C时,若起始时向容器中充入4.5molCO2、6mol H2 ,平衡时容器内压强

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com