
【题目】下列有关物质的性质与应用相对应的是
A.SO2具有氧化性,可用于漂白纸浆
B.氢氟酸具有酸性,可用于雕刻玻璃
C.二氧化氯具有还原性,可用于自来水的杀菌消毒
D.NH3具有还原性,可用NH3与灼热CuO作用制取少量N2
科目:高中化学 来源: 题型:
【题目】为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。
试回答下列问题:

(1)该反应为________反应(填“放热”或“吸热”)。
(2)A和B的总能量比C和D的总能量____(填“高”或“低”)。
(3)物质中的化学能通过________转化成________释放出来。
(4)反应物化学键断裂吸收的能量________(填“高”或“低”)于生成物化学键形成放出的能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是人类赖以生存不可缺少的物质,水质优劣直接影响人体健康,为了探究水质优劣,某综合实验小组来自来水厂参观,了解到源水处理成自来水的工艺流程示意图如图所示:


提供的试剂:饱和K2CO3溶液、NaOH溶液、Ba(NO3)2溶液、75%的乙醇、生石灰、CCl4、BaCl2溶液
(1)天然水中溶解的气体主要有 、 。硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO)。某天然水中c(Ca2+)=1.2×10﹣3molL﹣1,c(Mg2+)=6×10﹣4molL﹣1,则此水的硬度为 。
(2)为除去源水中含有Ca2+、Mg2+、HCO3﹣、Cl﹣、SO42﹣等离子,选出a所代表的试剂,按加入的顺序依次为 (只填化学式)。
(3)天然水在净化处理过程中加入的混凝剂可以是 ,其净水作用的原理是 。
(4)金矿开采、冶炼和电镀工业会产生大量含氰化合物的污水,其中含氰化合物以HCN、CN﹣和金属配离子M(CN)mn的形式存在于水中.测定污水中含氰化合物含量的实验步骤如下:
Ⅰ.水样预处理:水样中加入磷酸和EDTA,在pH<2的条件下加热蒸馏,蒸出所有的HCN,并用NaOH溶液吸收。
Ⅱ.滴定:将吸收液调节至pH>ll.以“试银灵”作指示剂,用AgNO3标准溶液滴定,终点时溶液由黄色变成橙红色,反应的离子方程式为:Ag++2CN﹣═[Ag(CN)2]﹣。
根据以上知识回答下列问题。
①水样预处理的目的是 。
②水样预处理的装置如图所示,细导管插入吸收液中的目的是 。蒸馏瓶比吸收液面要高,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中属于吸热反应的是( )
A.镁与盐酸反应放出氢气
B.氢氧化钠与盐酸的反应
C.硫在空气或氧气中燃烧
D.Ba(OH)28H2O与NH4Cl反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某实验小组对H2O2的分解做了如下探究。下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15 ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:

(1)写出上述实验中发生反应的化学方程式 。
(2)实验结果表明,催化剂的催化效果与 有关。
Ⅱ. 经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题:
(3)定性分析:如图甲可通过观察 ,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 。

(4)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为 ,实验中需要测量的数据是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机玻璃是一种重要的塑料,它是由单体A( CH2=C(CH3)COOCH3 )通过加聚反应制得,已知单体A可发生如图所示的转化关系:

已知:乙酸乙酯在稀H2SO4中发生水解:
CH3C18OOCH2CH3 + H2O ![]() CH3C18OOH + CH3CH2OH
CH3C18OOH + CH3CH2OH
(1)有机玻璃的结构简式是 .
(2)B分子中含有的官能团是 (填名称).
(3)由B转化为C的反应属于 (填序号).
①氧化反应 ②还原反应 ③加成反应 ④取代反应
(4)C的一氯代物D有 种结构(—COOH上的氢不会和Cl2发生取代反应).
(5)由A生成B的化学方程式是 .
(6)CH3CH2OH是CH3OH的同系物,试写出CH3CH2OH 与O2在铜做催化剂并加热的条件下发生反应的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,其合成路线如下:

其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去已知:

G为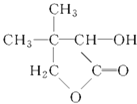 ;
;
请回答下列问题:
(1)G的分子式_____________;D中官能团的名称是_________。
(2)第②步反应的化学方程式为__________________________。
(3)第③步反应的化学方程式为__________________________。
(4)写出F的结构简式_____________。
(5)第①~⑥步反应中属于加成反应的有___________________;属于取代反应的有
__________________________。(填步骤编号)
(6)同时满足下列条件的E的同分异构体有_____________种。
①只含一种官能团;
②链状结构且无—O—O—;
③核磁共振氢谱只有2组峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图装置测定中和热的实验步骤如下:

①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)如右图所示,仪器A的名称是_________ ______;
(2)NaOH溶液稍过量的原因 ____________________________。
(3)加入NaOH溶液的正确操作是_______(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 ________ __________________。
(5)设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18 J·(g·℃)-1,请根据实验数据写出该中和热的热化学方程式_______________________________

(6)上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(7)怎样才能确保读取混合液的最高温度?_______ ____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E在元素周期表中的位置如图所示,其中A为地壳中含量最高的金属元素。

请用化学用语回答下列问题:
(1)E元素在周期表中的位置: 。
(2)A、D、E元素简单离子半径由大到小的顺序为 > > (填微粒符号)。
(3)F与D同主族且相邻,二者气态氢化物稳定性的大小关系为 > (填微粒符号)。
(4)用高能射线照射含有10电子的D元素氢化物分子时,一个分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出阳离子的电子式: ,该阳离子中存在的化学键有 。
(5)由C、E两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里C、E两种原子最外层均达到8个电子的稳定结构。甲遇水蒸气可形成一种常见的漂白性物质。则甲的结构式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com