

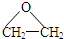 ),而且原子利用率为100%,为绿色化学,写出反应方程式
),而且原子利用率为100%,为绿色化学,写出反应方程式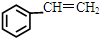 可被氧化剂氧化生成
可被氧化剂氧化生成  、HCOOH和H2O,该氧化剂为:
、HCOOH和H2O,该氧化剂为: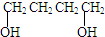 和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式:
和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式: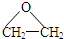 ;
;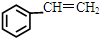 可被氧化剂氧化生成
可被氧化剂氧化生成  、HCOOH和H2O,则还原产物为H2O,所以氧化剂为H2O2;
、HCOOH和H2O,则还原产物为H2O,所以氧化剂为H2O2; 和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯和2mol的水;
和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯和2mol的水;| 17000-15000 |
| 2 |
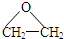 ),而且原子利用率为100%,为绿色化学,则反应方程式为CH2=CH2+O2
),而且原子利用率为100%,为绿色化学,则反应方程式为CH2=CH2+O2| Ag |
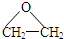 ;故答案为:CH2=CH2+O2
;故答案为:CH2=CH2+O2| Ag |
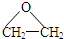 ;
;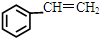 可被氧化剂氧化生成
可被氧化剂氧化生成  、HCOOH和H2O,则还原产物为H2O,所以氧化剂为H2O2;故答案为:H2O2;
、HCOOH和H2O,则还原产物为H2O,所以氧化剂为H2O2;故答案为:H2O2;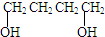 和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,反应方程式为:
和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,反应方程式为: ,故答案为:
,故答案为: ;
;


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
| A、加入一定量的M |
| B、加入一定量的不与M、N、P、Q反应的气体 |
| C、反应温度升高 |
| D、加入某物质作催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | (此处不要求填写) |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:

 有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式
有多种同分异构体,写出同时满足下列条件的一种同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在Na2CO3溶液中:c(OH-)+2c(CO32-)+c(HCO3-)=c(H+)+c(Na+) |
| B、常温时,将pH=1的醋酸和pH=13的NaOH溶液等体积混合后的溶液:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C、NaHCO3溶液中:c(Na+)=2c(CO32-)+c(HCO3-)+c(H2CO3) |
| D、0.1mol?L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3?H2O)=0.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| Fe |
| HCl |

 ”的反应中属于取代反应的是
”的反应中属于取代反应的是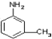 中的所有原子是否在同一平面上
中的所有原子是否在同一平面上查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 实验方案 |
| A | 鉴别溴蒸气和NO2 | 分别通入硝酸银溶液中,产生淡黄色沉淀的是溴蒸汽 |
| B | 证明氧化性:H2O2比Fe3+强 | 用硫酸酸化的H2O2溶液滴入Fe(NO3)2溶液中,溶液变黄色 |
| C | 证明盐类水解是吸热反应 | 在醋酸钠溶液中滴入酚酞试液,加热后红色加深 |
| D | 证明难溶物存在沉淀溶解平衡 | 往黄色固体难溶物PbI2加水中振荡,静置取上层清液加入NaI固体产生黄色沉淀 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com