
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | (此处不要求填写) |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
| ||
| ||


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
| T/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A、反应前2 min的平均速率v(Z)=2.0×10-3mol/(L?min) |
| B、其他条件不变,升高温度,反应达到新平衡前v(逆)>v (正) |
| C、该温度下此反应的平衡常数K=1.44 |
| D、其他条件不变,再充入0.2 mol Z,平衡时X的体积分数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、用铁丝网作电极,电解饱和食盐水:2Cl-+2H2O
| ||
| B、Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-→3BaSO4↓+2Al(OH)3↓ | ||
| C、向H218O中投入Na2O2固体:2H218O+2Na2O2→4Na++4OH-+18O2↑ | ||
| D、石灰乳中Ca(OH)2的电离:Ca(OH)2(s)?Ca2++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1 mol?L-1的NaHCO3 溶液中含有Na+的数目为0.1NA |
| B、标准状况下,1mol苯含有C=C 双键的数目为3NA |
| C、常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA |
| D、标准状况下,22.4L NO2与水充分反应转移的电子数目为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含4.8g 碳元素的石墨晶体中的共价键数是0.8NA |
| B、标准状况下,11.2LCO和N2的混合气体中,含有的原子数为NA |
| C、1mol的羟基(-OH)与1mol的氢氧根离子(OH-)所含电子数均为9NA |
| D、常压、500℃、催化条件下,1molSO2和0.5molO2充入一密闭容器内,充分反 应后的生成物分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

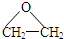 ),而且原子利用率为100%,为绿色化学,写出反应方程式
),而且原子利用率为100%,为绿色化学,写出反应方程式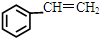 可被氧化剂氧化生成
可被氧化剂氧化生成  、HCOOH和H2O,该氧化剂为:
、HCOOH和H2O,该氧化剂为: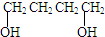 和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式:
和2mol乙酸在浓硫酸作用下生成分子式为C8H14O4的酯,写出反应方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com