
����Ŀ����֪������֬�����벻����ȩͪ(��ϩȩ��Ȳͪ��)��±����������Ӧ��

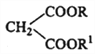 + R3Cl
+ R3Cl  +HCl
+HCl
�л�������H�ĺϳ�·�����£�
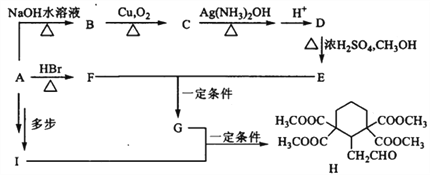
��1��A�ķ���ʽΪC3H7OBr���˴Ź���������ʾ����������壬�������1��2��2��2,д��A�к�������������______________��F��ϵͳ������_______________��
��2���ڼ��������£�C����������������ͭ����Һ��Ӧ�Ļ�ѧ����ʽ�ǣ�____________��
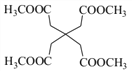
��3��B��D��1��1�γɵĸ߷��ӻ�����Ľṹ��ʽΪ_____________________________________��
��4��E��F��1��1��Ӧʱ�õ�J(C8H12O4)��J�Ľṹ��ʽΪ___________________________________��
��5����֪G�ķ���ʽΪC13H20O8��д��ͬʱ��������������G��ͬ���칹����____________��
����ˮ��õ�4���Ӽ״�;����һ�ȴ����������
��6����ֻ��C��H��O,�����ķ���ʽΪ____________�������м���������ˮ��������ˮ��ɫ�����ⲻ��˵�����к��в�����̼̼����ԭ����_________________��
��7����A���ಽ��Ӧ�Ƶ�����д���ϳ�·��______________(�����Լ���ѡ)��
���𰸡� �ǻ� 1��3-������� OHCCH2CHO+4Cu(OH)2+2NaOH=NaOOCCH2COONa+2Cu2O��+6H2O ![]()
 C3H2O ȩ����ԭ��ǿ��Ҳ��ʹ��ˮ��ɫ
C3H2O ȩ����ԭ��ǿ��Ҳ��ʹ��ˮ��ɫ ![]()
����������1��A�ķ���ʽΪC3H7OBr��Ϊ����һԪ��������˴Ź���������ʾ����������壬�������1��2��2��2��A�Ľṹ��ʽΪHO-CH2-CH2-CH2Br���ܹ����廯�ⷢ��ȡ����Ӧ������Br-CH2-CH2-CH2Br��F��ϵͳ������1��3-������飻��ȷ�𰸣��ǻ���1��3-������顣
��2��A�Ľṹ��ʽΪHO-CH2-CH2-CH2Br������������ˮ��Һ�з���ȡ����Ӧ���ɶ�Ԫ��(B)����Ԫ������Ϊ��Ԫȩ��C��, ��Ԫȩ��C������������������ͭ����Һ��Ӧ���ɶ�Ԫ����������Ӧ�Ļ�ѧ����ʽ����OHCCH2CHO+4Cu(OH)2+2NaOH=NaOOCCH2COONa+2Cu2O��+6H2O����ȷ����OHCCH2CHO+4Cu(OH)2+2NaOH=NaOOCCH2COONa+2Cu2O��+6H2O��
��3����Ԫȩ��C����������Һ���������ɶ�Ԫ�����Σ������������±�Ϊ��Ԫ���ᣨD�������Զ�Ԫ��(B)���Ԫ���ᣨD����1��1�������۷�Ӧ���ɸ߷��ӻ�����Ľṹ��ʽΪ��![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��4����Ԫ���ᣨD����״�����������Ӧ��������E�����л���HO-CH2-CH2-CH2Br���廯�ⷢ��ȡ������Br-CH2-CH2-CH2Br��������Ϣ��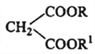 + R3Cl
+ R3Cl 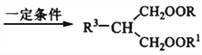 +HCl����֪��E��F��1��1��Ӧʱ�õ�
+HCl����֪��E��F��1��1��Ӧʱ�õ�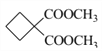
����ʽ����J(C8H12O4)������J�Ľṹ��ʽΪ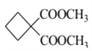 ����ȷ�𰸣�
����ȷ�𰸣�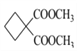 ��
��
��5����֪G�ķ���ʽΪC13H20O8������ˮ��õ�4���Ӽ״���˵���ṹ�к���4������������һ�ȴ���������֣��ṹΪ�߶ȶԳƽṹ������ṹ���£�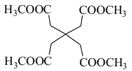 ����ȷ�𰸣�
����ȷ�𰸣� ��
��
��6��A�ķ���ʽΪC3H7OBr��Ϊ����һԪ��������˴Ź���������ʾ����������壬�������1��2��2��2��A�Ľṹ��ʽΪHO-CH2-CH2-CH2Br��������Ϣ ���������л���H�Ľṹ�ص��֪���������л���E���л������������Ϣ�����ӳɷ�Ӧ���ɵ�������л������к���̼̼������ȩ������Ϊ��Ȳȩ�����ķ���ʽΪC3H2O�������м���������ˮ��������ˮ��ɫ�����ⲻ��˵�����к��в�����̼̼����ԭ��ȩ�����л�ԭ�ԣ�Ҳ��ʹ��ˮ��ɫ����ȷ�𰸣�C3H2O�� ȩ����ԭ��ǿ��Ҳ��ʹ��ˮ��ɫ��
���������л���H�Ľṹ�ص��֪���������л���E���л������������Ϣ�����ӳɷ�Ӧ���ɵ�������л������к���̼̼������ȩ������Ϊ��Ȳȩ�����ķ���ʽΪC3H2O�������м���������ˮ��������ˮ��ɫ�����ⲻ��˵�����к��в�����̼̼����ԭ��ȩ�����л�ԭ�ԣ�Ҳ��ʹ��ˮ��ɫ����ȷ�𰸣�C3H2O�� ȩ����ԭ��ǿ��Ҳ��ʹ��ˮ��ɫ��
��7�����ݷ�Ӧ����������ص����֪��Ӧ������HO-CH2-CH2-CH2
![]() ����ȷ����
����ȷ����![]() ��
��


 100�ִ�����ĩ���ϵ�д�
100�ִ�����ĩ���ϵ�д� ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ���кܶ���Ȥ�ķ��ӣ�����ͼ����ʾ���ӱ���ѧ������Ϊ��С��ϩ�������й��ڡ�С��ϩ����˵���������
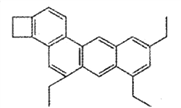
A. ��С��ϩ���ķ���ʽ��C26H26 B. ��С��ϩ���к����ĸ�����
C. ��С��ϩ��������̼ԭ��һ������ D. ��С��ϩ�����Է����ӳɷ�Ӧ��������Ӧ��ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һƿǩ��ע��Ϊ���������Σ��ơ�þ���ơ������ĸ����Ƽ���ijͬѧΪ��ȷ����ɷ֣�ȡ�����Ƽ���Ϊ��Һ����Ʋ����������ʵ�飺

��֪��������ҺpH��4ʱ��Fe(OH)3������ȫ��Ca2����Mg2����������
��ͬѧ�ó��Ľ�����ȷ����
A. ��������1���Ƴ�����Һ�к���Na��
B. ��������2���Ƴ�����Һ�в����������������
C. ��������3��4���Ƴ�����Һ�к���Ca2������û��Mg2��
D. ��������5���Ƴ�����Һ��һ������Fe2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����(����)
A. ���¼�������þ��̼�Ļ��������Ƶ���þ
B. ����ұ��������ͨ���û���Ӧ�õ�������
C. ��ˮ����Ĺ����в�����������ԭ��Ӧ
D. ��ϩ����ϩ���������Ҫ��������ԭ�϶�������ʯ�ͷ���õ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2C2O4Ϊ��Ԫ���ᣬ20 ��ʱ������һ��c(H2C2O4) + c(HC2O4-) + c(C2O42-)= 0.100mol/L��H2C2O4��NaOH�����Һ����Һ�в����������ʵ���Ũ����pH�ı仯������ͼ��ʾ������ָ����Һ���������ʵ���Ũ�ȹ�ϵһ����ȷ���ǣ� ��

A. pH = 2.5����Һ����c(H2C2O4) +c(C2O42-) �� c(HC2O4-)
B. c(Na+) = 0.100 mol/L����Һ����c(H+) +c(H2C2O4) = c(C2O42-)+ c(OH-)
C. c(HC2O4-) = c(C2O42-)����Һ����c(Na+) �� 0.100 mol/L + c(HC2O4-)
D. pH = 7.0 ����Һ����2c(Na+) = c(C2O42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
���л���A �ϳɾ�����߷��ӻ�����F ��·������:

��֪: 
(1) A����B �ķ�Ӧ����Ϊ_________��C �й����ŵ�����Ϊ__________ ��
(2) D ��NaOH ˮ��Һ��Ӧ�Ļ�ѧ����ʽΪ__________ ��
(3) ��E ����F �Ļ�ѧ����ʽΪ__________��
����F��ƽ����Է�������Ϊ20000������ƽ���ۺ϶�Ϊ________ (��ѡ����ĸ)��
A.54 B.108 C.119 D.133
(4) E ��һ�������»����Ժϳɺ�����Ԫ���ṹ��G��G �Ľṹ��ʽΪ__________��
(5) ��������������C ��ͬ���칹����___��(�����������칹)��
������1����Ԫ̼�����һ�������4 ��̼ԭ���ϸ�����һ��ȡ����
��1mol ������������������ͭ����Һ��Ӧ����2mol ש��ɫ����
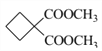
(6) д����![]() Ϊԭ��(�����Լ���ѡ) �Ʊ�������
Ϊԭ��(�����Լ���ѡ) �Ʊ�������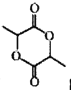 �ĺϳ�·�ߣ��������·�ʽ��ʾ:
�ĺϳ�·�ߣ��������·�ʽ��ʾ:  ��___________________��
��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƣ�NaNO2����һ����Ҫ�Ĺ�ҵ�Σ�Ҳ���������ࡢ�����ʳƷ��Ⱦɫ�ͷ�����������ˮ�������Ҵ�. ij��ѧ��ȤС����������ƽ��ж�Ƕ�̽����
i.�������Ƶ��Ʊ�
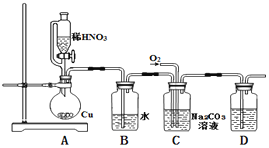
��1��ʵ�����ú�ѹ��Һ©���������ͨ��Һ©�����������ŵ���____��
��2��D�г���ʯ��ˮ����ǣ���C���Ʊ�NaNO2�����ӷ���ʽΪ_______________��
ii. ̽���������������ᷴӦ�������ɷ֣�
��֪����NO+NO2+2OH���T2NO2��+H2O ������Һ�����¶ȣ�NO2��21�棬NO����152��

��3����ӦǰӦ���ɼУ���ͨ��һ��ʱ�䵪����Ŀ����___________��
��4��Ϊ�˼���װ��A�����ɵ�����������������˳����������ӣ���
A��C��______��______��______��
��5���ڹرյ��ɼУ���Һ©������������70%�����A�в�������ɫ���壮
��ȷ��A�в��������庬��NO�����ݵ�������_________________��
��װ��B��������____________________��
iii. ���ʵ��֤������������NaNO2���������ԣ�___________��
��ѡ�õ��Լ���NaNO2��Һ��KMnO4��Һ��FeSO4��Һ��KI��Һ��ϡ���ᡢ������Һ��KSCN��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������мȺ������Ӽ��ֺ��й��ۼ��Ļ������ǣ� ��
A.NaCl
B.H2O
C.KOH
D.CH3Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������£���NO2��SO2�������1��2���ں����ܱ������У��������·�Ӧ��
NO2(g)+SO2(B)![]() NO(g)+SO3(g)��H=-41.8kJ��mol-1,��˵����Ӧ�ﵽƽ��״̬���ǣ� ��
NO(g)+SO3(g)��H=-41.8kJ��mol-1,��˵����Ӧ�ﵽƽ��״̬���ǣ� ��
A. ��ϵѹǿ���ֲ��� B. ���������ɫ���ֲ���
C. NO��SO3�����ʵ���֮�ȱ��ֲ��� D. ÿ����1molNO2��ͬʱ����1molSO3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com