
【题目】一定条件下,将NO2与SO2以体积比1∶2置于恒容密闭容器中,发生如下反应:
NO2(g)+SO2(B)![]() NO(g)+SO3(g)△H=-41.8kJ·mol-1,能说明反应达到平衡状态的是( )
NO(g)+SO3(g)△H=-41.8kJ·mol-1,能说明反应达到平衡状态的是( )
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. NO和SO3的物质的量之比保持不变 D. 每消耗1molNO2的同时生成1molSO3
 全程金卷系列答案
全程金卷系列答案 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】已知丙二酸脂可以与不饱和醛酮(如烯醛、炔酮等)、卤代烃发生反应:

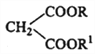 + R3Cl
+ R3Cl 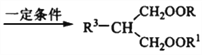 +HCl
+HCl
有机化合物H的合成路线如下:
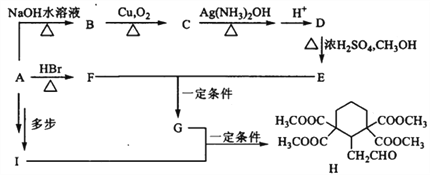
(1)A的分子式为C3H7OBr,核磁共振氢谱显示其中有四组峰,峰面积比1∶2∶2∶2,写出A中含氧官能团名称______________;F的系统命名是_______________。
(2)在碱性条件下,C与足量新制氢氧化铜悬浊液反应的化学方程式是:____________。
(3)B、D按1∶1形成的高分子化合物的结构简式为_____________________________________。
(4)E和F按1∶1反应时得到J(C8H12O4),J的结构简式为___________________________________。
(5)已知G的分子式为C13H20O8,写出同时满足下列条件的G的同分异构体:____________。
①可水解得到4分子甲醇;②其一氯代物仅有两种
(6)Ⅰ只含C、H、O,则Ⅰ的分子式为____________,向Ⅰ中加入少量溴水,发现溴水褪色,但这不能说明其中含有不饱和碳碳键,原因是_________________。
(7)由A经多步反应制得Ⅰ,写出合成路线______________(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA代表阿伏加德罗常数,下列说法正确的是( )
A. 46gNO2和N2O4的混合液中总原子数为3NA
B. 4℃时9mL水和11.2L氮气含有相同的分子数
C. 同温同压下,NA个CO2与NA个N2和O2的混合气体的体积不相等
D. 1.01×105Pa时,11.2 L氧气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述错误的是
A. n(H2CO3)和n(HCO3-)之和为1mol的NaHCO3溶液中,含有Na+数目为NA
B. 17gH2O2所含非极性键数目为0.5NA
C. 标准状况下,H2和CO混合气体8.96L在足量O2中充分燃烧消耗O2分子数为0.2NA
D. 56g铁与足量氯气反应,氯气共得到3NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是___________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)____(填“>”“<”或“=”)0.1 mol·L-1的NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= __________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断室温下(NH4)2CO3溶液的pH____(填“>”“<”或“=”)7。
(5)将相同温度下相同浓度的以下四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列_____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁—次氯酸盐燃料电池具有比能量高、安全方便等优点,该电池主要工作原理如图所示,其正极反应为:ClO- + H2O + 2e- = Cl- + 2OH-,关于该电池的叙述正确的是

A.该电池中镁为负极,发生还原反应
B.电池工作时,OH-向正极移动
C.电池工作时,正极周围溶液的pH将不断变小
D.该电池的总反应为:Mg + ClO- + H2O = Mg(OH)2↓+ Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物H(结构简式为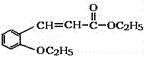 )是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
)是合成高分子化合物M的单体,H可以通过有机物A(分子式为C7H8O)和丙酮为原料来进行合成,其合成路线如下:
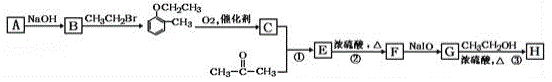
已知:①![]()
②
请回答下列问题:
(1)A的化学名称为_______________,G中所含官能团的名称是________________________;①和②的反应类型分别是______________、__________________。
(2)检验有机物A 中官能团的方法为__________________________________。
(3)高分子化合物M 的结构简式为__________________。
(4)反应③的化学反应方程式为__________________________________。
(5)有机物C 有多种同分异构体,其中属于芳香羧酸类的同分异构体有___________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米二氧化锆(ZrO2)是制备特种陶瓷(china)最重要的原料之一。由锆英石(主要成分为ZrSiO4)制备二氧化锆的工艺流程如图所示:
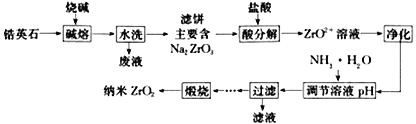
(1)写出“碱熔”时主要反应的化学方程式__________________________________。
(2)“水洗”所产生的“废液”主要成分为NaOH 和__________(填化学式),试写此成分的一种用途________________________________。
(3)写出“酸分解”生成ZrO2+反应的离子方程式__________________________________。
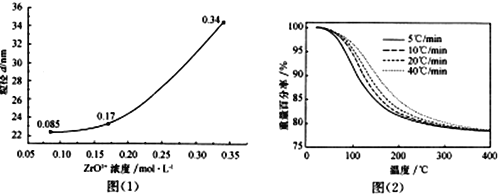
(4)根据图(1)分析ZrO2+浓度对ZrO2粒径的影响_____________________________________。
(5)ZrO2+溶液中常含有Fe3+(浓度为0.03mol·L-l),一般用草酸络合处理净化。若未净化处理直接加入氨水调节溶液pH,能否使ZrO2+完全转化为纯净的ZrO(OH)2沉淀,试通过计算说明。已知ZrO2+完全沉淀时浓度为1.0×10 -5 mol·L-l ,ZrO(OH)2、Fe(OH)3的Ksp分别为4.0×10-26、8.0×10-38, ![]() ≈3.16。__________________________________________________。
≈3.16。__________________________________________________。
(6)ZrO(OH)2煅烧制取纳米ZrO2时,升温速率与重量百分率之间的关系如图(2)所示。
煅烧时最佳升温速率为________________,理由是______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com