
【题目】若NA代表阿伏加德罗常数,下列说法正确的是( )
A. 46gNO2和N2O4的混合液中总原子数为3NA
B. 4℃时9mL水和11.2L氮气含有相同的分子数
C. 同温同压下,NA个CO2与NA个N2和O2的混合气体的体积不相等
D. 1.01×105Pa时,11.2 L氧气所含的原子数目为NA
【答案】A
【解析】
A. 根据NO2和N2O4的最简式计算混合物中含有的原子总数:B. 4℃对应的不是标准状况;C. 根据阿伏加德罗定律分析;D. 无法确定氧气是否处于标准状况。
A. NO2和N2O4的最简式均为NO2,46gNO2和N2O4的混合液中含有NO2的物质的量为![]() =1mol,则含有原子3mol,总原子数为3NA,故A正确;
=1mol,则含有原子3mol,总原子数为3NA,故A正确;
B. 4℃对应的不是标准状况,无法计算11.2L氮气含有的分子数,故B错误;
C. NA个CO2与NA个N2和O2的混合气体所含有的气体物质的量相等,根据阿伏加德罗定律可知,在同温同压下,物质的量相等的气体具有相同的体积,故C错误;
D. 1.01×105Pa时,11.2 L氧气对应的不一定是标准状况,所以无法计算原子数目,故D错误,答案选A。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】现有一瓶签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制剂作为试液,设计并完成了如下实验:

已知:控制溶液pH=4时,Fe(OH)3沉淀完全,Ca2+、Mg2+不沉淀。
该同学得出的结论正确的是
A. 根据现象1可推出该试液中含有Na+
B. 根据现象2可推出该试液中并不含有葡萄糖酸根
C. 根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
D. 根据现象5可推出该试液中一定含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是一种重要的工业盐,也常用于鱼类、肉类等食品的染色和防腐,易溶于水,微溶于乙醇. 某化学兴趣小组对亚硝酸钠进行多角度探究:
i.亚硝酸钠的制备
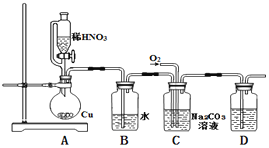
(1)实验中用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____.
(2)D中澄清石灰水变浑浊,则C中制备NaNO2的离子方程式为_______________。
ii. 探究亚硝酸钠与硫酸反应气体产物成分.
已知:①NO+NO2+2OH﹣═2NO2﹣+H2O ②气体液化的温度:NO2:21℃,NO:﹣152℃

(3)反应前应打开弹簧夹,先通入一段时间氮气,目的是___________.
(4)为了检验装置A中生成的气体产物,仪器的连接顺序(按左→右连接):
A、C、______、______、______.
(5)在关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①确认A中产生的气体含有NO,依据的现象是_________________.
②装置B的作用是____________________.
iii. 设计实验证明酸性条件下NaNO2具有氧化性:___________。
供选用的试剂:NaNO2溶液、KMnO4溶液、FeSO4溶液、KI溶液、稀硫酸、淀粉溶液、KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是几种电化学装置,请答下列问题。

(1)图一被保护的钢闸门应与外接电源的_______极相连,这种方法称之为___________;
(2)图二往Fe极区滴入2滴黄色的K3[Fe(CN) 6]溶液,一段时间后的现象________________。
(3)图三烧杯中盛放足量的CuSO4溶液总反应的离子方程式为_____________________;25℃,若起始时盛放100mLpH=5的CuSO4溶液,一段时间后溶液的pH变为1,此时仍只有一个电极上产生气体,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入_____(填写物质的化学式)___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烷、乙烯、乙炔共同具有的性质是 ( )
A. 都不溶于水,且密度比水小
B. 能够使溴水和酸性KMnO4溶液褪色
C. 分子中各原子都处在同一平面上
D. 都能发生聚合反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下的a L氯化氢气体溶于100mL水中,得到的盐酸的密度为b g/mL,则该盐酸的物质的量的浓度是( ) mol/L
A. 10 a /22.4 B. 10 a /22.4(a +0.1)
C. ab/(22400+36.5a) D. 1000ab/(2240+36.5a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将NO2与SO2以体积比1∶2置于恒容密闭容器中,发生如下反应:
NO2(g)+SO2(B)![]() NO(g)+SO3(g)△H=-41.8kJ·mol-1,能说明反应达到平衡状态的是( )
NO(g)+SO3(g)△H=-41.8kJ·mol-1,能说明反应达到平衡状态的是( )
A. 体系压强保持不变 B. 混合气体颜色保持不变
C. NO和SO3的物质的量之比保持不变 D. 每消耗1molNO2的同时生成1molSO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝,硼,磷等杂质).粗硅与氯气反应生成四氯化硅(反应温度450—500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。
氯气的制取:

(1)实验室用MnO2和浓盐酸制取氯气,若要制得干燥,纯净的氯气,所需装置的接口连接顺序是 ___(填小写字母)。
(2)写出实验室制取氯气的离子方程式:____ 。
(3)装置A中恒压分液漏斗M与常用分液漏斗相比,其优点是 _____,装置D的作用是____。
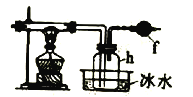
将上述方法制取的氯气通入下图装置中可以制得四氯化硅。
[资料]
a.四氯化硅遇水极易水解
b.硼、铝、铁,磷在高温下均能与氯气直接反应生成相应的氯化物
c.有关物质的熔沸点见下表:
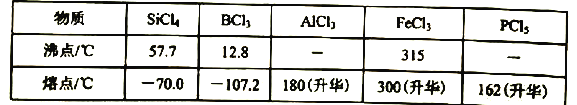
(4)装置f中盛放的药品是____,h瓶中左边用粗导管导出物质的目的是____。
(5)从b瓶得到的液体中蒸馏出SiCl4,所需用到的仪器是 ___。
A.容量瓶 B.温度计 C.冷凝管 D.分液漏斗
(6)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 。某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000 × 10-2 mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,滴定终点的现象是____,残留物中铁元素的质量分数是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com