
【题目】下图是几种电化学装置,请答下列问题。

(1)图一被保护的钢闸门应与外接电源的_______极相连,这种方法称之为___________;
(2)图二往Fe极区滴入2滴黄色的K3[Fe(CN) 6]溶液,一段时间后的现象________________。
(3)图三烧杯中盛放足量的CuSO4溶液总反应的离子方程式为_____________________;25℃,若起始时盛放100mLpH=5的CuSO4溶液,一段时间后溶液的pH变为1,此时仍只有一个电极上产生气体,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入_____(填写物质的化学式)___________g。
【答案】 负 外加电流的阴极保护法 生成有特征蓝色的沉淀 2Cu2++2H2O![]() 2Cu+O2↑+4H+ CuO (或CuCO3) 0.4 (或0.62)
2Cu+O2↑+4H+ CuO (或CuCO3) 0.4 (或0.62)
【解析】(1)根据图示可知,此电化学防护的方法为外加电源的阴极保护法,即钢闸门、辅助电极和外接电源构成电解池,其中钢闸门做电解池的阴极被保护,辅助电极做阳极,钢闸门做阴极,故应与外接电源的负极相连,该装置的原理是外加电源的阴极保护法,故答案为:负;外加电源的阴极保护法;
(2)滴入2滴黄色K3[Fe(CN)6](铁氰化钾)溶液时,发生反应:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓,产生蓝色沉淀;故答案为:产生蓝色沉淀;
(3)乙装置中阳极上氢氧根离子失电子生成氧气,阴极上铜离子得电子生成Cu,其电解反应的离子方程式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+;故答案为:2Cu2++2H2O
2Cu+O2↑+4H+;故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
③由2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.1L×0.1mol/L =0.01mol,则由电解反应可知析出的Cu的物质的量为0.005mol,由Cu原子守恒可知,m(CuO)=0.005mol×80g/mol=0.4g,或m(CuCO3)=0.005mol×124g/mol=0.62g,故答案为:CuO(或CuCO3);0.4(或0.62)。
2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,n(H+)=0.1L×0.1mol/L =0.01mol,则由电解反应可知析出的Cu的物质的量为0.005mol,由Cu原子守恒可知,m(CuO)=0.005mol×80g/mol=0.4g,或m(CuCO3)=0.005mol×124g/mol=0.62g,故答案为:CuO(或CuCO3);0.4(或0.62)。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】电解装置如图所示,电解槽内装有 KI 及淀粉溶液,中间用阴离子交换膜 隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变 浅。已知:3I2+6OH﹣=IO3﹣+5I﹣+3H2O,下列说法不正确的是( )
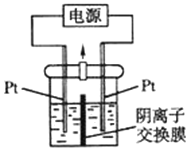
A. 右侧发生的电极反应式:2H2O+2e﹣=H2↑+2OH﹣
B. 电解结束后,右侧溶液中含有 IO3﹣
C. 电解槽内发生反应的总化学方程式:KI+3H2O![]() KIO3+3H2↑
KIO3+3H2↑
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学方程式不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液。右图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签上所列内容后列式计算(要求写出计算过程):

(1)该溶液的物质的量浓度为_________ mol·L-1(结果保留2位有效数字);
(2)该溶液的密度为__________ g·mL-1;
(3)如果从该瓶中取出75g葡萄糖注射液,将其变为15%的注射液,需要加入______g葡萄糖固体(质量精确到0.1g)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸的酸式盐NaHY在水溶液中,HY-的电离程度小于HY-的水解程度。有关的叙述中,正确的是
A. H2Y电离方程式为:H2Y+H2O![]() HY-+H3O+
HY-+H3O+
B. 常温下,该酸式盐的水溶液中溶液中,各离子浓度大小关系为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 常温下,酸式盐NaHY 的水溶液呈酸性
D. HY-的水解方程式为:HY-+ H2O![]() H3O++Y2-
H3O++Y2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若NA代表阿伏加德罗常数,下列说法正确的是( )
A. 46gNO2和N2O4的混合液中总原子数为3NA
B. 4℃时9mL水和11.2L氮气含有相同的分子数
C. 同温同压下,NA个CO2与NA个N2和O2的混合气体的体积不相等
D. 1.01×105Pa时,11.2 L氧气所含的原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个容积相同的容器中,一个盛有NH3,另一个盛有N2、H2的混合气体,在同温同压下,两容器内的气体一定具有相同的
A. 原子数 B. 分子数 C. 质量 D. 密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是___________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)____(填“>”“<”或“=”)0.1 mol·L-1的NaOH溶液中由水电离出的c(H+)。
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):c(Na+)-c(A-)= __________mol·L-1;
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断室温下(NH4)2CO3溶液的pH____(填“>”“<”或“=”)7。
(5)将相同温度下相同浓度的以下四种盐溶液:A.NH4HCO3;B.NH4A;C.(NH4)2SO4;D.NH4Cl,按pH由大到小的顺序排列_____________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设想以N2和H2为反应物,以溶有X的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示。下列说法正确的是
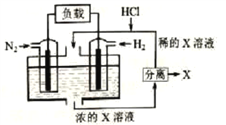
A. 放电时H+向左移动,生成的物质X是NH4Cl
B. 通入H2的一极为正极
C. 通入N2的电极反应为:N2+6H+-6e-=2NH3
D. 放电过程右边区域溶液pH逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com