
【题目】有人设想以N2和H2为反应物,以溶有X的稀盐酸为电解质溶液,制造出新型燃料电池,装置如图所示。下列说法正确的是
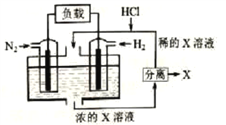
A. 放电时H+向左移动,生成的物质X是NH4Cl
B. 通入H2的一极为正极
C. 通入N2的电极反应为:N2+6H+-6e-=2NH3
D. 放电过程右边区域溶液pH逐渐增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下图是几种电化学装置,请答下列问题。

(1)图一被保护的钢闸门应与外接电源的_______极相连,这种方法称之为___________;
(2)图二往Fe极区滴入2滴黄色的K3[Fe(CN) 6]溶液,一段时间后的现象________________。
(3)图三烧杯中盛放足量的CuSO4溶液总反应的离子方程式为_____________________;25℃,若起始时盛放100mLpH=5的CuSO4溶液,一段时间后溶液的pH变为1,此时仍只有一个电极上产生气体,若要使溶液恢复到起始时的浓度(忽略溶液体积的变化),可向溶液中加入_____(填写物质的化学式)___________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁是一种具有芳香族性质的有机过渡金属化合物。二茂铁熔点是173℃,在100℃时开始升华,沸点是249℃,不溶于水,易溶于苯、乙醚、汽油、柴油等有机溶剂;化学性质稳定,400℃以内不分解。实验室制备二茂铁装置示意图如下图,实验步骤为:

①在三颈烧瓶中加入25g粉末状的KOH,并从仪器a 中加入60mL 无水乙醚到三颈烧瓶中,充分搅拌,同时通氮气约10min;
②再从仪器a 滴入5.5 mL 新蒸馏的环戊二烯(C5H6、密度0.95g/cm3),搅拌;
③将6.5g 无水FeCl2 与(CH3)2SO(二甲亚砜,作溶剂)配成的溶液25ml 装入仪器a中,慢慢滴入三颈烧瓶中,45min 滴完,继续搅拌45min;
④再从仪器a 加入25mL 无水乙醚搅拌;
⑤将三颈烧瓶中液体转入分液漏斗,依次用盐酸、水各洗涤两次,分液得橙黄色溶液;
⑥蒸发橙黄色溶液,得二茂铁粗产品。
回答下列问题:
(1)仪器b 的名称是__________________,作用是_____________________。
(2)步骤①中通入氮气的目的是_____________________。
(3)三颈烧瓶的适宜容积应为__________ (填序号);①100ml、②250ml、③500ml;步骤⑤所得的橙黄色溶液的溶剂是_____________________。
(4)KOH、FeCl2、C5H 6反应生成二茂铁[Fe(C5H5)2]和KCl 的化学方程式为_____________________。
(5)二茂铁粗产品的提纯过程在上图中进行,其操作名称为________________。二茂铁及其衍生物可做抗震剂用于制无铅汽油,它们比曾经使用过的四乙基铅安全得多,其中一个重要的原因是_________________________________。
(6)最终得到纯净的二茂铁4.8g,则该实验的产率为___________________(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:N2(g) + 3H2(g)![]() 2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是
2NH3(g) ΔH = 92 kJ·mol-1,下图表示L一定时,H2的平衡转化率(α)随X的变化关系,L(L1、L2)、X可分别代表压强或温度。下列说法中,不正确的是

A.X表示温度
B.L2>L1
C.反应速率 υ(M)>υ(N)
D.平衡常数 K(M)>K(N)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是
A.分离溴苯与苯:用分液漏斗分液
B.萃取溴水中的溴:向溴水中加入己烷
C.制硝基苯:将苯、浓硝酸、浓硫酸的混合液用酒精灯加热
D.制取溴苯:将铁屑、溴水、苯混合加热
查看答案和解析>>
科目:高中化学 来源: 题型:
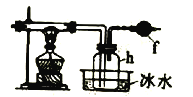
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝,硼,磷等杂质).粗硅与氯气反应生成四氯化硅(反应温度450—500 ℃),四氯化硅经提纯后用氢气还原可得高纯硅。
氯气的制取:

(1)实验室用MnO2和浓盐酸制取氯气,若要制得干燥,纯净的氯气,所需装置的接口连接顺序是 ___(填小写字母)。
(2)写出实验室制取氯气的离子方程式:____ 。
(3)装置A中恒压分液漏斗M与常用分液漏斗相比,其优点是 _____,装置D的作用是____。
将上述方法制取的氯气通入下图装置中可以制得四氯化硅。
[资料]
a.四氯化硅遇水极易水解
b.硼、铝、铁,磷在高温下均能与氯气直接反应生成相应的氯化物
c.有关物质的熔沸点见下表:
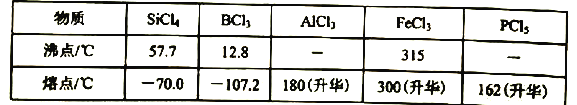
(4)装置f中盛放的药品是____,h瓶中左边用粗导管导出物质的目的是____。
(5)从b瓶得到的液体中蒸馏出SiCl4,所需用到的仪器是 ___。
A.容量瓶 B.温度计 C.冷凝管 D.分液漏斗
(6)为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O 。某同学称取5.000 g残留物,经预处理后在容量瓶中配制成100 mL溶液,移取25.00 mL试样溶液,用1.000 × 10-2 mol·L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00mL,滴定终点的现象是____,残留物中铁元素的质量分数是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是物质的量的单位
B. 溶液中或熔融状态下能导电的物质就是电解质
C. 氧化还原反应的本质是元素化合价发生了变化
D. 得电子的物质被还原,是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
2Z(g),各组分在不同时刻的浓度如表,下列说法正确的是( )
物质 | X | Y | Z |
初始浓度/mol/L | 0.1 | 0.2 | 0 |
2min末浓度/mol/L | 0.08 | a | b |
平衡浓度/mol/L | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20% B. t℃时,该反应的平衡常数为40
C. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动 D. 前2min内,用Y的变化最表示的平均反应速率v(Y)=0.03mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于A2 + 3B2![]() 2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
2C+D的反应来说,以下化学反应速率的表示中,反应速率最快的是( )
A.v(B2) =0.8mol(Ls)-1 B.v(A2) =0.4 mol(Ls)-1
C.v(C) =0.6 mol(Ls)-1 D.v(D) =0.1 mol(Ls)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com