
| A. | AlCl3 | B. | BF3 | C. | BCl3 | D. | BBr3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
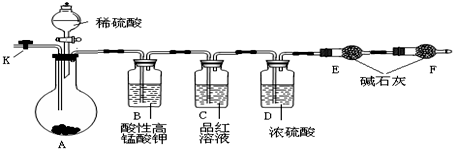
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M•NA | B. | Mg/mol | C. | $\frac{M}{{N}_{A}}$g/mol | D. | M•NA g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
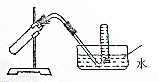 如图装置可用于( )
如图装置可用于( )| A. | 加热NaHCO3制CO2 | B. | 用Cu和稀HNO3反应制NO | ||
| C. | 用NH4Cl与浓NaOH溶液反应制NH3 | D. | 用NaCl于浓H2SO4反应制HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的有效成分是CaCl2 | |
| B. | 漂白粉和明矾处理自来水的原理是相同的 | |
| C. | 漂白粉最好在弱酸性环境下使用 | |
| D. | 漂白粉因易在空气中氧化而密封保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 分类标准 | 能导电的物质 | 电解质 | 能电离出H+的物质 |
| 属于该类的物质 | a、g、h | b、c、e、f、h | b、c、g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.
第二周期中碳、氮、氧是构成生命物质的三种主要元素,在生产生活中也有着重要的应用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com