
 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | Al(OH)3→Al2O3 | B. | Al2O3→Al(OH)3 | C. | Na2O2→NaOH | D. | Na2CO3→NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | 氨水 | C. | CuO | D. | KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 结论 | |
| A | 将硫酸酸化的H2O2滴入Fe(NO2)2溶液 | 溶液变黄色 | H2O2的氧化性比Fe3+强 |
| B | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 | HX放出的氢气多 | HX酸性比HY弱 |
| C | 将ZnS加入水中形成白色悬浊液,再向其中加入CuSO4溶液 | 有黑色沉淀产生 | Ksp(ZnS)>Ksp(CuS) |
| D | 光洁的铁钉放在冷的浓硫酸中 | 无明显现象 | 浓硫酸具有强氧化性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
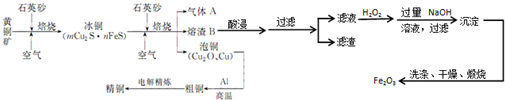
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
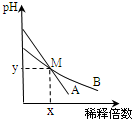
| A. | 取等体积M点的A、B两种碱液加入同浓度的硫酸溶液至恰好完全反应时,所消耗酸溶液的体积相同 | |
| B. | 用醋酸中和A溶液至恰好完全反应时,溶液的pH不一定大于7 | |
| C. | 稀释前两溶液中H+浓度的大小关系:A=10B | |
| D. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17:5 | B. | 11:3 | C. | 3:1 | D. | 4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com