
【题目】高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( ) 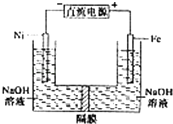
A.铁是阳极,电极反应为Fe﹣6e﹣+4H2O═FeO42﹣+8H
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH﹣自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
【答案】D
【解析】解:A、依据装置图分析可知铁与电源正极相连做电解池阳极,碱性溶液不能生成氢离子,电极反应为Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O,故A错误;B、电解过程中电子流向负极流向Ni电极,不能通过电解质溶液,是通过电解质溶液中离子定向移动实现闭合电路,通过Fe电极回到正极,故B错误;
C、阴离子交换膜只允许阴离子通过;阴离子移向阳极,应从左向右移动,故C错误;
D、阳极区域,铁失电子消耗氢氧根离子,溶液PH减小,阴极区氢离子得到电子生成氢气,溶液中氢氧根离子浓度增大,溶液PH增大;生成氢氧根离子物质的量消耗,在阳极电极反应Fe﹣6e﹣+8OH﹣═FeO42﹣+4H2O,阴极氢氧根离子增大,电极反应2H++2e﹣=H2↑,依据电子守恒分析,氢氧根离子消耗的多,生成的少,所以溶液pH降低,故D正确;
故选D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】目前,能较稳定存在的氯的氧化物有Cl2O、ClO2、Cl2O7等。有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是______________。
(2)Cl2O7属于酸性氧化物,它与水反应的离子方程式____________________________。
(3)ClO2是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。在对水消毒时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,说明ClO2具有_____________性。
(4)工业上可以用下列反应制备ClO2:2NaClO3+H2SO4+SO2=2ClO2+2NaHSO4,请用单线桥法
表示出该反应电子转移的方向和数目______________。
(5)工业上制备ClO2的反应原理为:
NaClO3+ HCl(浓)- ClO2↑+ Cl2↑+ H2O+ NaCl.
①配平方程式:______________。
②浓盐酸在反应中显示出来的性质是__________________(填序号)。
A.还原性 B.氧化性 C.酸性
③若上述反应中产生0.1molClO2,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4NH3(g)+5O2(g)4NO(g)+6H2O(g)在5L密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v为( )
A.v(O2)=0.01mol/(Ls)
B.v(NO)=0.08mol/(Ls)
C.v(H2O)=0.003mol/(Ls)
D.v(NH3)=0.001mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.1mol苯乙烯( ![]() )中含有的C=C数为4NA
)中含有的C=C数为4NA
B.标准状况下,2.24L己烷含有的分子数为0.1NA
C.1mol甲基含10NA个电子
D.某温度下,2.6g乙炔和苯的混合气体中所含碳原子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年10月17日,神州十一号飞船在酒泉卫星发射中心成功发射,根据太空的失重状况,下列化学实验在太空中无法完成的是
A. 蒸发B. 两种固体混合C. 硫酸与氢氧化钠溶液的反应D. 过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列表格
物质 | N2 | HNO3 | SO2 |
质量/g | ___ | 18.9 | ___ |
物质的量/mol | ___ | ___ | 1.5 |
标况下的体积/L | 4.48 | ___ | ___ |
分子个数 | ___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25mL 0.1molL﹣1 MOH 溶液中逐滴加入0.2molL﹣1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: 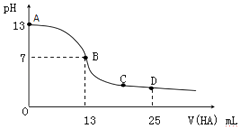
(1)MOH与HA恰好完全反应时,溶液呈性(填“酸”、“碱”或“中”),用离子方程式表示其原因 . 此时,混合溶液中由水电离出的c(H+)0.2mol.L﹣1 HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(2)D点时,溶液中c(A﹣)+c(HA)2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH=3,则 c(HA)+c(H+)=molL﹣1(数字表达式,不必具体算出结果).
(3)分别写出C点混合溶液中各离子浓度的大小关系 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质.某校化学兴趣小组同学为了克服传统铝热反应纸漏斗易燃烧,火星四射等缺点,将实脸改成以下装置,取磁性氧化铁在如图A实验进行铝热反应,冷却后补到“铁块”混合物.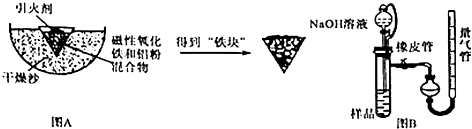
(1)实验中可以用蔗糖和浓硫酸代替镁条作引火剂,共原因是 .
(2)该铝热反应的化学方程式为 .
(3)取反应后的“铁块”研碎取样称量,加入如图B装置,滴入足量NaOH溶液充分反应,测量生成气体体积以测量样品中残留铝的百分含量.试回答下列问题:①量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为 .
②量气管在读数时必须进行的步骤是 .
③取1g样品进行上述实验,共收集到44.8mL气体(换算成标准状况下),则铝的百分含量为 .
④装置中分液漏斗上端和烧瓶用橡胶管连通,除了可以平衡压强让液体顺利滴入试管之外,还可以起到降低实验误差的作用.如果装置没有橡胶管,测出铝的百分含量将会(填“偏大”或“偏小”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验.实验室提供的药品、仪器装置如下:药品:①2% NaOH溶液 ②稀HCl ③稀H2SO4 ④饱和KHCO3溶液 ⑤浓H2SO4 ⑥CaCO3固体 ⑦K2CO3粉末
仪器装置(如图所示):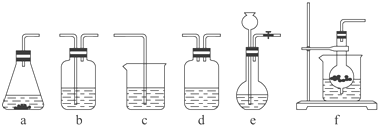
请根据题目要求完成下列问题:
(1)请按下表要求,填写选择的装置和药品.
分项 | CO2发生装置(随开随用,随关随停)(X) | 除杂洗气装置(Y) | 制备产品装置(Z) |
选择的装置(填序号) | c | ||
选择的药品(填序号) | ① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程: .
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 , Y装置中除去的杂质为 .
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其目的是 .
(5)若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液最大浓度不能超过%(质量分数).附:有关物质在常温(25℃)时的溶解度
化学式 | Na2CO3 | NaHCO3 | NaOH | NaCl | Na2SO4 |
溶解度(g/100g H2O) | 21.3 | 9.60 | 107 | 35.8 | 19.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com