
【题目】常温下,向25mL 0.1molL﹣1 MOH 溶液中逐滴加入0.2molL﹣1 HA溶液,曲线如图所示(体积变化忽略不计).回答下列问题: 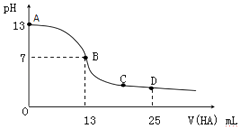
(1)MOH与HA恰好完全反应时,溶液呈性(填“酸”、“碱”或“中”),用离子方程式表示其原因 . 此时,混合溶液中由水电离出的c(H+)0.2mol.L﹣1 HA溶液中由水电离出的c(H+)(填“>”“<”或“=”).
(2)D点时,溶液中c(A﹣)+c(HA)2c(M+)(填“>”“<”或“=”);若此时测得混合溶液的pH=3,则 c(HA)+c(H+)=molL﹣1(数字表达式,不必具体算出结果).
(3)分别写出C点混合溶液中各离子浓度的大小关系 .
【答案】
(1)碱;A﹣+H2O?HA+OH﹣;>
(2)=;0.05+10﹣11
(3)c(A﹣)>c(M+)>c(H+)>c(OH﹣)
【解析】解:(1)由图象可知,当加入13mL 0.2mol/L HA溶液时,n(HA)=0.0026mol,而n(MOH)=0.0025mol,说明HA过量,但溶液呈中性,说明HA为弱酸,如二者恰好反应,应生成强碱弱酸盐,水解呈碱性,发生A﹣+H2OHA+OH﹣ , 促进水的电离,则混合溶液中由水电离出的c(H+)大于0.2mol/L HA溶液中由水电离出的c(H+),所以答案是:碱;A﹣+H2OHA+OH﹣;>;(2)D点时,加入n(HA)=0.005mol,而加入n(MOH)=0.0025mol,A元素以A﹣和HA两种形式存在,而M全以M+形式存在,溶液中c(A﹣)+c(HA)=2c(M+);
c(M+)=0.05mol/L,c(OH﹣)=1×10﹣11mol/L,由电荷守恒c(M+)+c(H+)=c(A﹣)+c(OH﹣)和物料守恒c(A﹣)+c(HA)=2c(M+)可得:c(HA)+c(H+)=c(M+)+c(OH﹣)=0.05mol/L+10﹣11mol/L,
所以答案是:=;0.05+10﹣11;(3)C点混合溶液显示酸性,得到的溶液是MA和HA,存在:c(A﹣)>c(M+)>c(H+)>c(OH﹣),所以答案是:c(A﹣)>c(M+)>c(H+)>c(OH﹣).


科目:高中化学 来源: 题型:
【题目】Na2O2由于其具有咸味且价格便宜,常在非法食品制作时用作食盐的不合理替代品,因为亚硝酸钠有毒,含有工业盐的食品对人体危害很大,有致癌性.
(1)亚硝酸钠可少量添加到食物中,用作食品的
(2)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,该述反应的还原剂是 , 若反应中转移0.2mol电子,则参与反应的NaNO2为mol
(3)根据上述反应,鉴别NaNO2和NaCl.可选用的物质有:
A.水
B.碘化钾淀粉试纸
C.淀粉
D.食醋
E.白酒
(4)实验室模拟用以下反应合成亚硝酸盐
C6H12O6+12HNO3=3HOOC﹣COOH+9NO2+3NO↑+9H2O
NO+NO2+2NaOH=2NaNO2+2H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
其中第一个反应要控制反应液的温度在35~60℃条件下进行,原因是 , 第二个和第三个反应是NaOH溶液吸收反应生产的气体,所得溶液中的阴离子共有三种OH﹣、NO2﹣、 , 且第三种离子与NO2﹣的浓度之比为 .
(5)亚硝酸钠能氧化酸性条件下的Fe2+ , 同时产生一种气体,该气体在空气中迅速变色,写出亚硝酸钠与亚铁离子反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①正丁烷 ②2﹣甲基丙烷 ③正戊烷 ④2﹣甲基丁烷 ⑤2,2﹣二甲基丙烷等物质沸点的排列顺序正确的是( )
A.①>②>③>④>⑤
B.②>①>⑤>④>③
C.③>④>⑤>①>②
D.⑤>④>③>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( ) 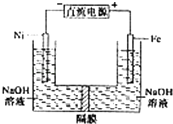
A.铁是阳极,电极反应为Fe﹣6e﹣+4H2O═FeO42﹣+8H
B.电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极
C.若隔膜为阴离子交换膜,则OH﹣自右向左移动
D.电解时阳极区pH降低、阴极区pH升高,撤去隔膜混合后,与原溶液比较pH降低(假设电解前后体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】教材中有两个关于混合物分离的实验,请回答下列有关问题
实验一:通过蒸馏的方法除去自来水中含有的氯离子等杂质制取纯净水,如图所示

(1)写出下列仪器的名称:①___________ ②_____________
(2)若利用以上装置分离酒精和四氯化碳两种溶液的混合物,还缺少的仪器是______________,将仪器补充完整后进行的实验操作的名称是______________;②的进水口是__________ (填“f”或“g”)
(3)仪器①中常加入碎瓷片,这样做的目的是___________________
实验二:用CCl4从碘水中萃取I2并分液漏斗分离两种溶液.
其实验操作中有如下两步:
①将漏斗上口玻璃塞打开或使塞上的凹槽或小孔准漏斗的小孔.
②静置分层后,旋开活塞,用烧杯接收下层液体
(4)下层流出的是_____________溶液,上层液体从_________________ 得到(填“上口”或“下口”)
(5)萃取碘水中的I2单质时要用到萃取剂,下列关于所加萃取剂的说法正确的是(______)
A.不与碘反应
B.碘在其中的溶解度大于在水中的溶解度
C.该萃取剂与水不互溶且密度不同
D.可以选用CCl4、 酒精灯做萃取剂.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于有机物的正确叙述是( )
A.CH4O与C3H8O一定是同系物
B.同分异构体一定具有相似的化学性质
C.完全燃烧等质量的苯与苯乙烯,耗氧量相同
D.向溴乙烷中滴加硝酸银溶液,产生黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
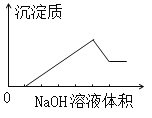
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件的水溶液中可能大量共存的离子组是( )
A.c(H+):c(OH﹣)=1:2的溶液:K+、Al3+、H2PO4、ClO﹣
B.与Al反应生成H2的溶液:Na+、Ba2+、NO ![]() 、Cl﹣
、Cl﹣
C.中性溶液中:SO ![]() 、S2﹣、Fe3+、Cl、能大量共存
、S2﹣、Fe3+、Cl、能大量共存
D.能使红色酚酞变无色的溶液:K+、Ca2+、Cl﹣、HCO ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据以下物质的转变关系回答有关内容 
(1)请写出下列转化的方程式
①C3H6→A
②E→G
(2)请设计实验,证明C中含有﹣CHO .
(3)F中含有的官能团有①、②;请设计实验证明 ①;② .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com