
����Ŀ��ijѧϰС��Ϊ��ʶ�����仯��������ʡ���ɢϵ��������������һ���ۺ�ʵ�飬����ʵ�����̻ش�������⣺

��1����д��Fe2O3��ٷ�Ӧ�����ӷ���ʽ______________________________��
��2�����ʢ�Ϊ_______________��
��3����д��FeCl3�����۷�Ӧ�Ļ�ѧ����ʽ________________________��
��4����FeCl2��Һ�еμ�NaOH��Һ��������Fe(OH)3��Һ���ù��̵�����Ϊ____________ ���˹����з�����������ԭ��ӦΪ���û�ѧ����ʽ���_________________________��
��5����FeCl3������Һ�����ˮ�У���������������ɫ���Ƶ÷�ɢϵ��__________________������FeCl3��Һ��Fe(OH)3��Һ�ı���������_________________________��
���𰸡� Fe2O3+6H+===2Fe3++3H2O NaOH��Һ������������Ҳ�ɣ� Fe+2FeCl3===3FeCl3 ���ɰ�ɫ������Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe(OH)3���� ��ɢ�����Ӵ�С��ͬ
��������(1)Fe2O3�Ǽ�������������ᷴӦ����FeCl3�����ӷ���ʽΪFe2O3+6H+�T2Fe3++3H2O��
(2)FeCl3��NaOH��Ӧ����Fe(OH)3��
(3)���ۿ��Ժ�������֮�䷢��������ԭ��Ӧ����ѧ����ʽΪ��Fe+2FeCl3�T3FeCl2��
(4)FeCl2��Һ�еμ�NaOH���ɰ�ɫ��Fe(OH)2��Ѹ�ٱ�ɻ���ɫ�����ձ�����Ϊ���ɫ��Fe(OH)3������ʽΪ4Fe(OH)2+O2+2H2O�T4Fe(OH)3��
(5)���ˮ����εμӱ���FeCl3��Һ����Һ������ĺ��ɫ�����Ի�������������壬�ý�������Һ����Һ�ı��������Ƿ�ɢ�����Ӵ�С��ͬ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��CH4�������������壬�о����Ǿ�����Ҫ�����塣
(1)��֪CH4��H2��CO��ȼ����(��H)�ֱ�Ϊ-890.3 kJ�� mol-1��-285.8 kJ�� mol-1��-283.0 kJ��mol-1����![]()
![]() ��H=_________kJ��mol-1
��H=_________kJ��mol-1
(2)��CO2��NH3Ϊԭ�Ϻϳ�����������CO2�ijɹ������������غϳ����е���Ҫ��Ӧ�ɱ�ʾΪ�� ![]()
![]() ��H=-86.98 kJ��mol-1
��H=-86.98 kJ��mol-1
��Ӧ��Ӱ��CO2ƽ��ת���ʵ����غܶ࣬��ͼΪij�ض������£���ͬˮ̼��[n(H2O/n(CO2)]���¶ȶ�CO2ƽ��ת���ʵ�Ӱ�����ߡ�

��Ϊ���CO2��ƽ��ת���ʣ������г������¶�����Բ�ȡ�Ĵ�ʩ��___________________��____________________��
�ڵ��¶ȸ���190���CO2ƽ��ת���ʳ�����ͼ��ʾ�ı仯���ƣ���ԭ����_______________��
(3)��1.0 L�ܱ�������ͨ��0.2 mol NH3(g)��0.1 mol CO2(g)����һ���¶��·�����Ӧ��![]()
![]() ����Ӧʱ����������ѹǿ(p)���������±���
����Ӧʱ����������ѹǿ(p)���������±���
![]() ����ʼѹǿ����ѹǿ����ƽ��ʱNH3��ת����Ϊ_________��0��80 min��CO2��ƽ����Ӧ������__________��
����ʼѹǿ����ѹǿ����ƽ��ʱNH3��ת����Ϊ_________��0��80 min��CO2��ƽ����Ӧ������__________��
(4)���������(NH2COONH4)����ˮ���̼��泥�����������ˮ������ס�����������立�ĩ���뵽1 L 0.1 mol��L-1��������ֱ��pH=7(�����£�������Һ����仯)������ȥ0.052 mol��������泥���Һ�м�������̼Ԫ�ء���ʱ��Һ��c(NH4+)=__________��NH4+ˮ��ƽ�ⳣ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I��һ�������£������Ϊ3 L���ܱ������л�ѧ��ӦCO(g)��2H2(g)![]() CH3OH(g)�ﵽƽ��״̬��
CH3OH(g)�ﵽƽ��״̬��
(1)�÷�Ӧ��ƽ�ⳣ������ʽK��__________��������ͼ�������¶ȣ�Kֵ��__________(���������С�����䡱)��
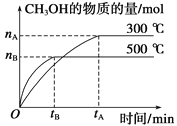
(2)500 ��ʱ���ӷ�Ӧ��ʼ���ﵽ��ѧƽ�⣬��H2��Ũ�ȱ仯��ʾ�Ļ�ѧ��Ӧ������______________(��nB��tB��ʾ)��
(3)�жϸÿ��淴Ӧ�ﵽ��ѧƽ��״̬�ı�־��______(����ĸ)��
a��v����(CH3OH)��v����(CO)
b�����������ܶȲ��ٸı�
c����������ƽ����Է����������ٸı�
d��CO��H2��CH3OH��Ũ�Ⱦ����ٱ仯
(4)300 ��ʱ�����������ݻ�ѹ����ԭ����1/2���������������������£���ƽ����ϵ������Ӱ����________(����ĸ)��
a��c(H2)��С b������Ӧ���ʼӿ죬�淴Ӧ���ʼ���
c��CH3OH�����ʵ������� d������ƽ��ʱc(H2)/c(CH3OH)��С
II:���п��淴Ӧ.2NO2(g) ![]() N2O4(g)����H��0���Ը�������ͼ���ж�t2��t3��t4ʱ�̲�ȡ�Ĵ�ʩ��
N2O4(g)����H��0���Ը�������ͼ���ж�t2��t3��t4ʱ�̲�ȡ�Ĵ�ʩ��
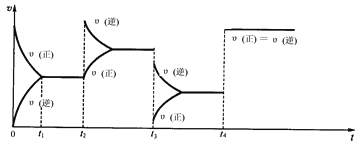
(1)t2��_________________________________________________��
(2)t3��_________________________________________________��
(3)t4��_________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ��������Ƶ�PEM��ѹ�������������Ľṹ��ͼ���ڵ�������м���ǹ������ʾۺ�Ĥ��Ĥ���߷ֱ��Ƕ�������Ͷ����������ˮ�����߽�������ˮ�������ˮ�䡣����˵������ȷ����
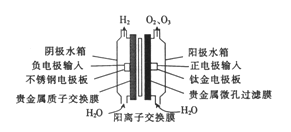
A. �������ҷ����ķ�Ӧ��2H2O-4e-=4H++O2����3H2O-6e-=6H++O3��
B. ͨ��ʱ��H+���������ƶ�
C. ��ͬ������O2��O3�����֮��С��H2�����
D. ����ʳ��ˮ���洿ˮ����Բ���ɷ�û��Ӱ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɶ�����ǰ10��Ԫ����ɵ�����T��X��������ͼ��ʾ��ת����ϵ��X���ȶ����ֽ⡣�����й�˵����ȷ����

A. T������ֻ���м��Լ���X�����мȺ��м��Լ��ֺ��зǼ��Լ�
B. �����ʵ�����T��X�����к��ж�������Ŀ��ΪNA
C. T��X�����е�![]() ԭ�ӷֱ����sp2�ӻ���sP3�ӻ�
ԭ�ӷֱ����sp2�ӻ���sP3�ӻ�
D. Ϊʹ��ת���ɹ����У�Y����������KMnO4��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ��������������ǣ� ��
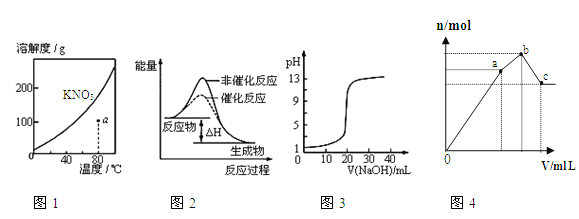
A��ͼ1��ʾKNO3���ܽ��������ͼ��a����ʾ����Һ��80��ʱKNO3�IJ�������Һ
B��ͼ2��ʾij���ȷ�Ӧ�ֱ����С�����������·�Ӧ�����е������仯
C��ͼ3��ʾ0.1000molL-1NaOH��Һ�ζ�20.00mL0.1000molL-1������Һ�õ��ζ�����
D��ͼ4 ��ʾ��NH4Al(SO4)2��Һ����ε���Ba(OH)2��Һ������Ba(OH)2��Һ���V�ı仯�����������ʵ���n�ı仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NA��ʾ�����ӵ�������ֵ�������й�������ȷ����
A. �����£�4.6gNO2��N2O4�������������ԭ������Ϊ0.3NA
B. 4.2g��ϩ�ͱ�ϩ��������к��еļ��Լ���ĿΪ0.8NA
C. �����£�1L0.5mol/LNH4Cl��Һ��2L0.25mol/LNH4Cl��Һ����NH4+����Ŀ��ͬ
D. 1mol������1mol�����г��ȼ�գ�ת�Ƶĵ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��120��ʱ,2���ij����8���O2���,��ȫȼ�պ�ָ���ԭ�����¶Ⱥ�ѹǿ��������䣬�÷���ʽ��������̼ԭ������������( )
A. 1 B. 2 C. 3 D. 5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ʾʵ�飬����ͽ��۾���ȷ���ǣ� ��
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ũ�Ⱦ�Ϊ0.lmol��L-1NaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp(AgCl)>Ksp(AgI) |
B | �����£��ⶨ�����ʵ���Ũ�ȵ�Na2CO3��Na2SO3��Һ��pHֵ | ǰ�ߵ� pHֵ�Ⱥ��ߵĴ� | �ǽ����ԣ�S>C |
C | ��ij��Һ�еμ��������� | ��Һ�г��������ݺ͵���ɫ���� | ��Һ�к���S2-�� SO32- |
D | ��FeCl3��KSCN�����Һ�У���������KCl�Ĺ��� | ��Һ��ɫ��dz | FeCl3 +KSCN |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com