

 ,试剂X为硝酸银溶液;反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O,
,试剂X为硝酸银溶液;反应②是过量氢氧化钾与氯化铝反应生成氯化钾、偏铝酸钾、水,反应离子方程式为:4OH-+Al3+=AlO2-+2H2O, ;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
;硝酸银溶液;4OH-+Al3+=AlO2-+2H2O;
| ||
| △ |
| ||
| △ |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | |
| A | 取待测液先进行焰色反应,再加足量稀盐酸,将产生气体通入品红溶液 | 火焰呈黄色,品红溶液褪色 | 原溶液一定是亚硫酸钠溶液 |
| B | 向浓醋酸溶液中加入少量碳酸钠溶液,将产生气体通过苯酚钠溶液 | 苯酚钠溶液中出现白色浑浊 | 不能说明酸性:醋酸>碳酸>苯酚 |
| C | 常温下向足量浓硫酸和稀硫酸中,分别加入相同质量、相同体积的铁片 | 相同时间两者产生H2速率不同 | 反应物的浓度越大,反应速率越快 |
| D | 相同的铝片分别与同温同体积,且c(H+)=1 mol?L-1盐酸、硫酸反应 | 铝与盐酸反应产色很难过气泡较快 | 可能是Cl-对该反应起到促进作用 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮氧化物和SO2是造成雾霾天气的主要原因之一.
氮氧化物和SO2是造成雾霾天气的主要原因之一.| 1 |
| 2 |
| 1 |
| 2 |
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol?L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料.合成铃兰醛的路线如图所示(部分试剂和条件未注明):
铃兰醛具有甜润的香味,常用作肥料、洗涤剂和化妆品的香料.合成铃兰醛的路线如图所示(部分试剂和条件未注明):查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

2- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、CH3CH2OH
| |||
B、CH3CHBrCH3+NaOH
| |||
C、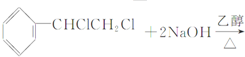  | |||
D、2CH3OH
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com