
【题目】(1)在一个绝热、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
2NH3(g)△H<0。下列各项能说明该反应已经达到平衡状态的是________。
A、容器内气体密度保持不变
B、容器内温度不再变化
C、断裂1mol N≡N键的同时,生成6mol N﹣H键
D、反应消耗N2、H2与产生NH3的速率之比1:3:2
(2)已知:①Zn(s)+1/2O2(g) = ZnO(s) △H =-348.3 kJ/mol
②2Ag(s)+1/2O2(g) = Ag2O(s) △H =-31.0 kJ/mol
则Zn(s)+Ag2O(s) = ZnO(s)+2Ag(s)的△H=________ kJ/mol。
(3)已知两个热化学方程式:
C(s)+O2(g)==CO2(g) △H = -393.5kJ/mol
2H2(g)+O2(g)==2H2O(g)△H = -483.6kJ/mol
现有0.2mol炭粉和H2组成悬浮气,使其在O2中完全燃烧,共放出63.53kJ的热量,则炭粉与H2的物质的量之比是________。
(4)在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ = Y-+ 3S↓+ 3H2O
①YO3n-中Y的化合价是_____________;
②Y元素原子的最外层电子数是_________。
【答案】 B -317.3 1:1 +5 7
【解析】(1)A.容积不变,气体的总质量不变,则容器内气体密度始终不改变,无法判断为平衡状态,故A不选;B.在绝热条件,容器内温度不变,说明反应处于相对静止状态,为平衡状态,故B选;C.断裂1molN≡N键的同时,断裂3molH-H键,均体现正反应速率,不能判断平衡,故C不选;D.反应消耗N2、H2与产生NH3的速率之比1:3:2,正速率之比等于化学计量数之比,不能判定平衡,故D不选;故选B。
(2)①Zn(s)+ ![]() O2(g)═ZnO(s);△H=-348.3kJmol-1;②4Ag(s)+O2(g)═2Ag2O(s);△H=-62.0kJmol-1;①-②×
O2(g)═ZnO(s);△H=-348.3kJmol-1;②4Ag(s)+O2(g)═2Ag2O(s);△H=-62.0kJmol-1;①-②×![]() 得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)△H=[-348.3KJ/mol-
得Zn(s)+Ag2O(s)═ZnO(s)+2Ag(s)△H=[-348.3KJ/mol-![]() ×(-62KJ/mol)]=-317.3 kJ/mol;
×(-62KJ/mol)]=-317.3 kJ/mol;
(3)解:设碳粉xmol,则氢气为(0.2-x)mol,则
C(s)+O2(g)═CO2(g)△H=-393.5kJ/mol
1 393.5kJ
x 393.5xkJ
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
2483.6kJ
(0.2-x)mol 241.8(0.2-x)kJ
所以393.5xkJ+241.8(0.2-x)kJ=63.53kJ,
解得x=0.1mol,则炭粉与H2的物质的量之比为0.1mol︰0.1mol=1︰1;
(4)①离子方程式遵循电荷守恒,则在YO3n-+3S2-+6H+=Y-+3S↓+3H2O中:n+3×2-6=1,n=1,设YO3n-中Y元素的化合价为x,则-2×3+x=-1,x=+5;
②由离子方程式可知,Y的最低负价为-1价,则说明最外层含有7个电子。


科目:高中化学 来源: 题型:
【题目】I.元素周期表中80%左右的非金属元素在现代技术包括能源、功能材料等领城占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是_____,N2F2分子中N原子的杂化方式是_______,1mol N2F2含有____个δ键。
(2)高温陶瓷材料Si3N4晶体中N-Si-N的键角大于Si-N-Si的键角,原因是_______。
II.金属元素铁、铜及其化合物在日常生产、生活有着广泛的应用。
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_____(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子吸之和为18,则x=________。
(3)N2是CO的一种等电子体,两者相比较沸点较高的为_______(填化学式)。
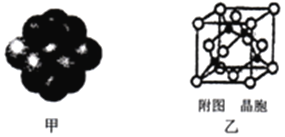
(4)铜晶体中铜原子的堆积方式如下图甲所示。
①基态铜原子的核外电子排布式为___________。
② 每个铜原子周围距离最近的铜原子数目为___________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如下图乙所示(黑点代表铜原子)。己知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm。(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知原子序数依次增大的X、Y、Z、D、E、F六种前四周期元素。X是宇宙中最丰富的元素;Y和Z基态原子的未成对电子数均等于周期序数;D的氧化物是典型的两性氧化物;E是所在周期中电负性最大的元素;F的单质是一种紫红色金属,在潮湿空气中该金属表面会慢慢生成一种绿色固体。请回答下列问题(用元素符号或化学式表示):
(1)X元素位于周期表的________区。
(2)基态D原子的价电子轨道表示式是______,其第一电离能反常地低于同周期前一种元素,原因是_______。
(3)YZ2分子的电子式是__________,该分子的空间构型是_____________。
(4)甲是由X、Y、Z三种原子构成的含有16个电子的分子,甲中Y原子的杂化类型是_______,它能溶于水的原因是______________。
(5)金属F与XE的热浓溶液反应产物之一是X3[FE4],该反应的化学方程式是______________。
(6)F与Z形成的一种晶胞结构如图,其中F原子均匀地分散在立方体内部,原子a、b、d的坐标参数依次为(0,0,0)、(![]() ,
, ![]() ,
, ![]() )、(3m,3m,3m),则m=________。已知该晶体的密度为ρg/cm3, NA是阿伏伽德罗常数值,则原子b和d之间的核间距是__________nm(列出计算式即可)。
)、(3m,3m,3m),则m=________。已知该晶体的密度为ρg/cm3, NA是阿伏伽德罗常数值,则原子b和d之间的核间距是__________nm(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别只用一种试剂除去下列各组中所含的少量杂质(括号内为杂质),在空格中填上所需试剂的化学式:
(1)CO2(HCl) ______________,(2)FeSO4(CuSO4)_______,
(3)Fe2O3(Al2O3)___________,(4)Cu(Fe)______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com