
【题目】游离态碳在自然界存在形式有多种,在工业上有着重要用途。请回答下列问题:
(1)我国四大发明之一的黑火药由木炭与硫黄、硝酸钾按一定比例混合而成。黑火药爆炸时生成硫化钾、氮气和二氧化碳。其爆炸的化学方程式为_____________________________________。
(2)高级碳粉可由烃类高温分解而制得,已知几个反应的热化学方程式:
C(s)+O2(g)==CO2(g) △H1= -393.5 kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2= -571.6 kJmol-1
CH4(g)+2O2(g)-=CO2(g)+ 2H2O(1) △H3= -890.3 kJmol-1
则由天然气生产高级碳粉的热化学方程式为__________________________________。
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1L闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=________(保留两位小数)。10-20min内,NO的平均反应速率为_______________;若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,则该反应的ΔH________0(填“>”、“<”或“=”)。
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是_________________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是___________________________。
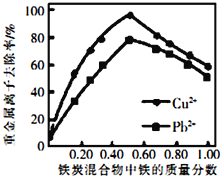
【答案】 2KNO3+S+3C=K2S+N2↑+3CO2↑ CH4(g)=C(s)+2H2(g) △H= +74.8kJmol-1 0.56 0.0036mol·L-1·min-1 < 活性炭对Cu2+和Pb2+有吸附作用 炭的质量分数减少,混合物中微电池数目减少
【解析】(1)我国四大发明之一的黑火药由木炭与硫黄、硝酸钾按一定比例混合而成。黑火药爆炸时生成硫化钾、氮气和二氧化碳。其爆炸的化学方程式为2KNO3+S+3C=K2S+N2↑+3CO2↑ 。
(2)高级碳粉可由烃类高温分解而制得,已知几个反应的热化学方程式:
①C(s)+O2(g)==CO2(g) △H1= -393.5 kJmol-1;②2H2(g)+O2(g)=2H2O(1) △H2= -571.6 kJmol-1;③CH4(g)+2O2(g)-=CO2(g)+ 2H2O(1) △H3= -890.3 kJmol-1。由③-①-②可得,CH4(g)=C(s)+2H2(g) △H= +74.8kJmol-1,则由天然气生产高级碳粉的热化学方程式为CH4(g)=C(s)+2H2(g) △H= +74.8kJmol-1。
(3)①由题中数据可知,此温度下,NO、N2、CO2的平衡浓度分别为0.080mol/L、0.060 mol/L、0.060 mol/L,所以,该反应的平衡常数K=![]() 。10-20min内,NO的平均反应速率为
。10-20min内,NO的平均反应速率为![]() 0.0036mol·L-1·min-1;该反应在20min时达到平衡,容器中c(NO)∶c(N2) ∶c(CO2)=4∶3∶3,若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,说明化学平衡向逆反应方向移动,所以该反应的正反应是放热反应,则该反应的ΔH<0。
0.0036mol·L-1·min-1;该反应在20min时达到平衡,容器中c(NO)∶c(N2) ∶c(CO2)=4∶3∶3,若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,说明化学平衡向逆反应方向移动,所以该反应的正反应是放热反应,则该反应的ΔH<0。
②当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是:活性炭对Cu2+和Pb2+有吸附作用;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是:炭的质量分数减少,混合物中微电池数目减少。


科目:高中化学 来源: 题型:
【题目】下列递变规律不正确的是
A.Na、Mg、Al还原性依次减弱B.I-、Br-、Cl-还原性依次增强
C.熔点:金刚石>食盐>干冰D.碱性:NaOH>Mg(OH)2>Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学实验的结果如下表:
实验序号 | 反应物 | 在相同温度下测得的反 | |
大小相同的金属片 | 酸溶液 | ||
1 | 镁条 | 1 mol·L-1盐酸 | v1 |
2 | 铁片 | 1 mol·L-1盐酸 | v2 |
3 | 铁片 | 0.1 mol·L-1盐酸 | v3 |
下列结论正确的是
A.v1>v2>v3B.v3>v2>v1C.v1>v3>v2D.v2>v3>v1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液配制说法错误的是( )
A. 称取12.5g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol·L-1
B. 取58.5 g NaCl固体放入1 L水中充分溶解,所得溶液中NaCl的物质的量浓度为1 mol·L-1
C. 将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%
D. 将浓度为2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应mA+nB===pC+qD中,若v(A)=4 mol·L-1·min-1, 而v(B)=1 mol·L-1·min-1,A表示的反应速率比B表示的反应速率快,而m、n符合的关系
A. m∶n=4∶1 B. m∶n<4∶1 C. m∶n>4∶1 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法中,不正确的是( )
A.NH3常用作制冷剂
B.烧碱:治疗胃酸过多的一种药剂
C.Na2SiO3常用作制木材防火剂
D.NaHCO3常用作面粉发泡剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿立哌唑E(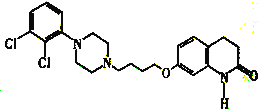 )是新型非典型抗精神病药物,被誉为“多巴胺系统稳定剂”,可由以下路线合成:
)是新型非典型抗精神病药物,被誉为“多巴胺系统稳定剂”,可由以下路线合成:
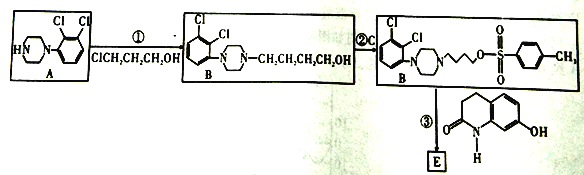
其中C是一种有机强酸。请回答下列问题:
(1)所发生的反应中属于取代反应的是____________(填序号)。
(2)写出B生成D的化学方程式是____________。
(3)E的分子式为____________。
(4)已知F:①与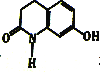 水解的产物互为同分异构体;②属于α一氨基酸;③苯环上有两个取代基;④核磁共振氢谱图中有6个峰;⑤能与FeCl3溶液发生显色反应。F的结构简式为_______。
水解的产物互为同分异构体;②属于α一氨基酸;③苯环上有两个取代基;④核磁共振氢谱图中有6个峰;⑤能与FeCl3溶液发生显色反应。F的结构简式为_______。
(5)已知:R-CHO![]()
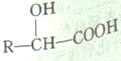 。合成路线流程图示例:
。合成路线流程图示例:
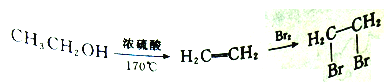
①ClCH2CH2CH2CH2OH的系统命名是_____________。
②写出由ClCH2CH2CH2CH2OH制备化合物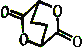 的合成路线流程图(无机试剂任选)。_____________
的合成路线流程图(无机试剂任选)。_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com