
【题目】已知某化学实验的结果如下表:
实验序号 | 反应物 | 在相同温度下测得的反 | |
大小相同的金属片 | 酸溶液 | ||
1 | 镁条 | 1 mol·L-1盐酸 | v1 |
2 | 铁片 | 1 mol·L-1盐酸 | v2 |
3 | 铁片 | 0.1 mol·L-1盐酸 | v3 |
下列结论正确的是
A.v1>v2>v3B.v3>v2>v1C.v1>v3>v2D.v2>v3>v1
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子,下列说法正确的是 ( )
A. X元素原子基态时的电子排布式为[Ar]4s24p3 B. X元素是第四周期第ⅤA族元素
C. Y元素原子的电子排布式为1s22s22p2 D. Z元素具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】规律提炼题组: 同分异构体的书写
(1)某烷烃分子式为C6H14,写出含有三个甲基的烷烃的同分异构体的结构简式:_________________________________________________
(2)某烃1mol能与1mol氯化氢完全加成,加成产物分子上的氢原子又可被9mol氯气取代,该烃的分子式为___________,并写出它的结构简式(包括顺反异构)_____________________________。
(3)某烷烃一个分子里含有9个碳原子,其一氯代物只有两种,这种烷烃的名称是_____________。
(4)C7H7Cl的含有苯环的同分异构体共有__________种。
(5)有机物C4H8Cl2的结构中只含有一个甲基的同分异构体有________种。
(6)在C6H12分子所有碳原子都在同一平面上的结构简式是______________。
(7)“神七”使用偏二甲肼和四氧化二氮作火箭燃料.偏二甲肼的化学式为C2H8N2,则C2H8N2不含碳碳键的同分异构体有_____________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbCrO4是一种黄色颜料,制备PbCrO4的一种实验步骤如下:
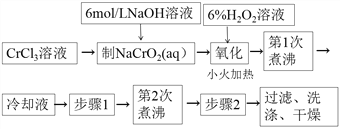
除图中标注的试剂外,实验中还用到6mol·L-1 醋酸,0.5 mol·L-1 Pb(NO3)2溶液,pH 试纸。
已知:①部分物质性质如下
物质 | 性质 | 颜色 | 溶解性 |
Cr(OH)3 | 两性氢氧化物 | 绿色 | 难溶于水 |
Pb(NO3)2 | - | 无色 | 易溶于水 |
Pb(CH3COO)2 | - | 无色 | 易溶于水 |
PbCrO4 | - | 黄色 | 难溶于水 |
Pb(OH)2 | 弱碱性 | 白色 | PH=7.2开始沉淀 ;PH=8.7完全沉淀 |
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液作用制得,含PbCrO4晶种时更易生成
③六价铬在溶液中物种分布分数与pH关系如下图所示。
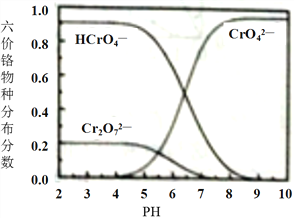
(1)“制NaCrO2(aq)”时,控制NaOH溶液加入量的操作方法是______。
(2)“氧化”时发生反应的离子方程式为______。
(3)下列说法正确的是(______)
A.两次煮沸的目的不相同
B.步骤2可以先加入一滴0.5mol·LPb(NO3)2溶液搅拌片刻,待产生少量沉淀后,继续滴加至有大量沉淀产生。
C.静置后,向上层清液中继续滴入Pb(NO3)2溶液,若无沉淀生成,则说明滴加完全。
D.小火加热的目的是为了避免反应过快。
(4)步骤1为__________________________________________________________。
(5)为测定产品的纯度,可用先用硝酸溶解PbCrO4,然后用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Pb2+ + Y4- =PbY2-。测定时,先称取0.5000g无水PbCrO4产品,溶解后,用0.05000 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水PbCrO4产品的纯度是_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少钢管因锈蚀造成的损失,某城市拟用如图方法保护埋在酸性土壤中的钢管。下列有关说法错误的是

A. 在潮湿的酸性土壤中钢管主要发生析氢腐蚀
B. 在潮湿的酸性土壤中金属棒M 将电子通过导线流向钢管
C. 在潮湿的酸性土壤中H+向金属棒M 移动,抑制H+与铁的反应
D. 金属棒M 与钢管用导线连接后可使钢管表面的腐蚀电流接近于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】游离态碳在自然界存在形式有多种,在工业上有着重要用途。请回答下列问题:
(1)我国四大发明之一的黑火药由木炭与硫黄、硝酸钾按一定比例混合而成。黑火药爆炸时生成硫化钾、氮气和二氧化碳。其爆炸的化学方程式为_____________________________________。
(2)高级碳粉可由烃类高温分解而制得,已知几个反应的热化学方程式:
C(s)+O2(g)==CO2(g) △H1= -393.5 kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2= -571.6 kJmol-1
CH4(g)+2O2(g)-=CO2(g)+ 2H2O(1) △H3= -890.3 kJmol-1
则由天然气生产高级碳粉的热化学方程式为__________________________________。
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1L闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=________(保留两位小数)。10-20min内,NO的平均反应速率为_______________;若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,则该反应的ΔH________0(填“>”、“<”或“=”)。
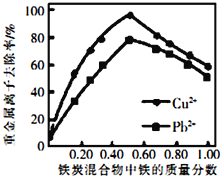
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是_________________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图转化关系判断下列说法不正确的是(反应条件已略去)
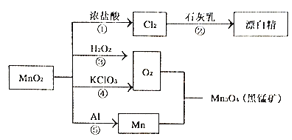
A. 反应①②③④⑤均属于氧化还原反应
B. 生成黑锰矿的反应中,3molMn参加反应转移4mol电子
C. 生成等量的O2,反应③和④转移的电子数之比为1:2
D. 反应⑤为铝热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol由两种气态烃组成的混合气体完全燃烧后,得到0.16mol CO2和3.6克水,则混合气体中( )
A. 一定有甲烷
B. 一定是甲烷和乙烯
C. 可能有乙烷
D. 一定有乙炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com