
����Ŀ��һ���¶��£������������Ϊ0.5 L�ĺ����ܱ������з�����Ӧ��CO(g)+Cl2(g) ![]() COCl2(g)�������������з�Ӧ��5 minʱ�ﵽƽ��״̬��
COCl2(g)�������������з�Ӧ��5 minʱ�ﵽƽ��״̬��
������� | �¶�/�� | ��ʼ���ʵ���/mol | ƽ�����ʵ���/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
�� | 500 | 1.0 | 1.0 | 0 | 0.8 |
�� | 500 | 1.0 | a | 0 | 0.5 |
�� | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
����˵������ȷ����
A.�÷�Ӧ����ӦΪ���ȷ�Ӧ
B.��������ǰ5 min��ƽ����Ӧ������(CO)=0.16 mol��L-1��min-1
C.��������a��0.55 mol
D.��������Ϊ��ѹ���ﵽƽ��ʱCOת����С��80%
���𰸡�AC
��������
A. ������I��III���¶ȶ���500�棬����������ȫȫ�ȵĵ�Чƽ�⣬����III���¶�Ϊ600�棬�����¶�COCl2Ũ�Ƚ��ͣ�˵��ƽ�������ƶ��������¶�ƽ�������ȷ����ƶ���������Ӧ�Ƿ��ȷ�Ӧ����A��ȷ��
B. I��ƽ��ʱ�õ���n(COCl2)=0.8mol�����ݷ���ʽ֪���μӷ�Ӧ�ġ�n(CO)=��n(COCl2)=0.8mol����5min����(CO)=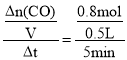 =0.32molL1min1����B����
=0.32molL1min1����B����
C. I�дﵽƽ��״̬ʱ��n(CO)=n(Cl2)=1.0mol0.8mol=0.2mol����ƽ��ʱc(CO)=c(Cl2)=![]() ==0.4mol/L��c(COCl2)=
==0.4mol/L��c(COCl2)= ![]() =1.6mol/L����ѧƽ�ⳣ��K=
=1.6mol/L����ѧƽ�ⳣ��K=![]() ���¶���ͬ����ѧƽ�ⳣ����ͬ������II�л�ѧƽ�ⳣ��K=10��
���¶���ͬ����ѧƽ�ⳣ����ͬ������II�л�ѧƽ�ⳣ��K=10��
CO(g)+Cl2(g)COCl2(g)��
��ʼ��mol��1.0a0
�仯��mol��0.50.50.5
ƽ�⣨mol��0.5(a0.5) 0.5
ƽ��ʱc(CO)=c(COCl2)=![]() =1mol/L��c(Cl2)=
=1mol/L��c(Cl2)= ![]() mol/L=2(a0.5)mol/L����ѧƽ�ⳣ��K=
mol/L=2(a0.5)mol/L����ѧƽ�ⳣ��K=![]() =10�����a=0.55����C��ȷ��
=10�����a=0.55����C��ȷ��
D.�������� I�м���1.0molCO��1.0molCl2ʱ��COת����=![]() ��100%=80%��������IΪ��ѹ������ں�������������ѹǿƽ�������ƶ���CO��ƽ��ת���ʴ���80%����D����
��100%=80%��������IΪ��ѹ������ں�������������ѹǿƽ�������ƶ���CO��ƽ��ת���ʴ���80%����D����
��ѡAC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
��һ����̼�����ж���Ҫ�����ѹ�����Тڶ���������������������ƽ����ϵ����ѹ��С�������ɫ�����ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ�����������ˮ����Һ����������ʱ������Һ���������Ȼ��ع����Ʊ�Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.�٢�B.��C.�ۢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ͭ������Cu��Sn�ȣ��ڳ�ʪ�����з����ĸ�ʴ�������ﱣ����������Ҫ���塣��ͼΪ��ͭ���ڳ�ʪ�����з����绯ѧ��ʴ��ԭ��ʾ��ͼ������˵������ȷ����
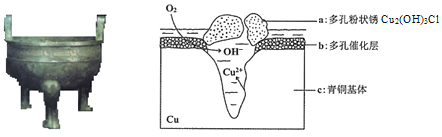
A.��ͭ������������ʴ��ͼ��c��������������
B.���������ĵ缫��ӦΪO2+ 4e��+2H2O=4OH��
C.������0.2 mol Cu2(OH)3Cl�������������ĵ�O2���Ϊ4.48L
D.�����е�Cl����缫��������a�����ӷ���ʽΪ2Cu2��+3OH��+Cl��=Cu2 (OH)3Cl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ػ��ϼ���ԭ�������Ĺ�ϵͼ������˵������ȷ����( )
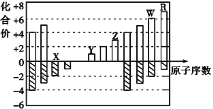
A. ��̬�⻯����ȶ��ԣ�R>W
B. X��Y�����γ�ԭ�Ӹ�����Ϊ1��1��1��2���������ӻ�����
C. ��X��Y��Z��W��R����Ԫ���γɵļ������а뾶��С����X2-
D. Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����NaHCO3��Һ�е������ᣬ�����Һ��pH������Ũ�ȱ仯�Ĺ�ϵ��ͼ��ʾ����������������ǣ� ��
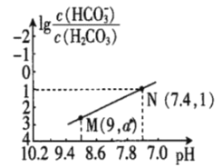
A.25��ʱ��H2CO3��һ������K(H2CO3)=1.0��10-6.4
B.ͼ��a=2.6
C.25��ʱ��HCO3-+H2O![]() H2CO3+OH-��Kh=1.0��10-7.6
H2CO3+OH-��Kh=1.0��10-7.6
D.M����Һ�У�c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ij��Һ����ˮ�������c(OH-)=1��10-13mol/L������Һ��һ�����ܴ���������������ǣ� ��
A.NH![]() ��Fe3+��SO
��Fe3+��SO![]() ��Cl-B.CO
��Cl-B.CO![]() ��PO
��PO![]() ��K+��Na+
��K+��Na+
C.Na+��SO![]() ��NO
��NO![]() ��Cl-D.HPO
��Cl-D.HPO![]() ��Na+��HSO
��Na+��HSO![]() ��K+
��K+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ŀ�������Դ��
����֪��2CH4(g)+O2(g)=2CO(g)+4H2(g) ��H=��70.8 kJ��mol��1 CO(g)+2H2(g)=CH3OH(g) ��H=��90.5 kJ��mol��1
д����CH4��O2��ȡCH3OH(g)���Ȼ�ѧ����ʽ_____________________��
���ڷ�ӦCO(g)+2H2(g)=CH3OH(g)���ش��������⣺
(1)ͼ1��CO(g)��CH3OH(g)���ʵ���Ũ����ʱ��(t)�ı仯���ߣ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ����H2��ʾ�ķ�Ӧ������(H2)=________��CO��ת����Ϊ_________��
(2) ���ݻ�Ϊ2L�ĸ��������г���5mol CO��10mol H2��������Ӧ���ﵽƽ�⣬CO��ƽ��ת�������¶�(T)�ı仯������ͼ2��ʾ��
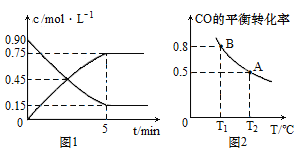
�ټ���B��ƽ�ⳣ��KB��______���ﵽƽ��ʱ�����ٳ���2mol CO��4mol H2��2mol CH3OH����Ӧ��__________����(��������Ӧ�����������淴Ӧ������)��
�ڱȽ�KA��KB�Ĵ�С________��
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����____������ĸ��ţ���
A��H2������������ٸı�
B��H2���������ʵ���CH3OH���������ʵ�2��
C��H2��ת���ʺ�CO��ת�������
D����������ƽ����Է����������ٸı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E ����Ԫ�ص�ԭ��������������B��C ����������A�������Ӻ���ԭ�ӵĵ��Ӳ�ṹ��ͬ��A��B���γ����ӻ�����B2A��C�������������ǿ�ᷴӦ��������ǿ�Ӧ��D��ԭ�ӽṹʾ��ͼΪ�� ��E�������������ǵ��Ӳ�����2�����Իش����и����⣺
��E�������������ǵ��Ӳ�����2�����Իش����и����⣺
��1��B��DԪ�طֱ�Ϊ_________��_________��
��2��DԪ��λ��Ԫ�����ڱ��е�_______���ڡ���______�壻
��3��������B2A�ĵ���ʽ____________________��
��4��E������������ˮ����ķ���ʽ��________________________��
��5��D��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��_______________________________��
��6��C����������E������������ˮ������Һ��Ӧ�����ӷ���ʽ�� ________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���2L���ܱ������У�����1molX��g����2molY��g��������Ӧ��X��g��+m Y��g��![]() 3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
3Z��g����ƽ��ʱ��X��Y��Z����������ֱ�Ϊ30%��60%��10%���ڴ�ƽ����ϵ�м���1molZ��g�����ٴδﵽƽ���X��Y��Z������������䡣������������ȷ����
A. m=2
B. ����ƽ���ƽ�ⳣ����ͬ
C. X��Y��ƽ��ת����֮��Ϊ1:1
D. �ڶ���ƽ��ʱ��Z��Ũ��Ϊ0.4 mol��L��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com