
【题目】研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
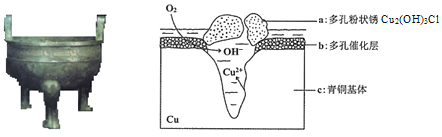
A.青铜器发生吸氧腐蚀,图中c作负极,被氧化
B.正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C.若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
D.环境中的Cl-与电极产物生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl
【答案】C
【解析】
A. 根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极被氧化,腐蚀过程中,负极是c,故A正确;
B. 氧气在正极得电子生成氢氧根离子,电极反应式为:O2+4e+2H2O=4OH,故B正确;
C. 根据转移电子可得n(O2)=![]() =0.2mol,未指明标准状况,无法计算体积,故C 错误;
=0.2mol,未指明标准状况,无法计算体积,故C 错误;
D. Cl扩散到孔口,并与正极反应产物和负极反应产物作用,生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl,离子方程式为2Cu2++3OH+Cl=Cu2(OH)3Cl,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】(双选)下图所示是晶体结构中具有代表性的最小重复单元(晶胞)的排列方式,其对应的化学式正确的是(图中:![]() —X,
—X,![]() —Y,×—Z)( )
—Y,×—Z)( )
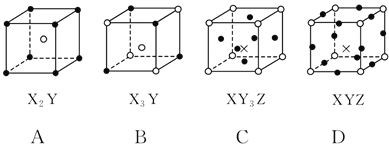
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。


下列说法错误的是( )
A.0~t1时,原电池的负极是Al片
B.0~t1时,正极的电极反应式是![]() +2H++e=NO2↑+H2O
+2H++e=NO2↑+H2O
C.t1后,原电池的正、负极发生互变
D.t1后,正极上每得到0.3mol电子,则负极质量减少2.7g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W 是原子序数依次增大的前四周期元素,X、Z的周期序数=族序数,W的原子序数是 Z的两倍,由这四种元素组成的单质或化合物存在如图所示的转化关系,其中甲、戊是两种常见的金属单质,丁是非金属单质,其余为氧化物且丙为具有磁性的黑色 晶体。下列说法正确的是
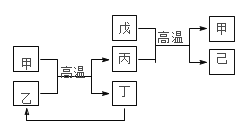
A.W金属性强于 Z
B.W 元素在周期表中的位置是第四周期 VIII 族
C.丙属于两性氧化物
D.等物质的量的甲和戊完全溶于稀硝酸,消耗的 HNO3的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2 (g) + 3 H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应某时刻t时,n t (N2) = 13 mol,n t (NH3) = 6 mol,则a =____mol;
(2)反应达平衡时,混合气体的体积为716.8 L(标况下),其中NH3的含量(体积分数)为25%,平衡时NH3的物质的量_____;
(3)原混合气体与平衡混合气体的总物质的量之比(写出最简整数比、下同),n(始)∶n(平) =______;
(4)原混合气体中,a∶b =_____;
(5)达到平衡时,N2和H2的转化率之比,α(N2)∶α(H2)= ______;
(6)平衡混合气体中,n(N2)∶n(H2)∶n(NH3) =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,常温下是一种橙黄色有恶臭的液体,它的分子结构与H2O2类似,熔点为193K,沸点为411K,遇水很容易水解,产生的气体能使品红褪色,S2Cl2可由干燥氯气通入熔融的硫中制得。下列有关说法正确的是
A. S2Cl2的电子式为![]()
B. 固态时S2Cl2属于原子晶体
C. S2Cl2与NaOH的化学方程式可能为:S2Cl2+6NaOH=2NaCl+Na2SO3+Na2S+3H2O
D. S2Cl2是含有极性键和非极性键的离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构简式如图所示。下列叙述正确的是 ( )

A. 迷迭香酸与溴单质只能发生取代反应
B. 1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C. 迷迭香酸可以发生水解反应、取代反应、消去反应和酯化反应
D. 1 mol迷迭香酸最多能和6 mol NaOH发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:CO(g)+Cl2(g) ![]() COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
COCl2(g),其中容器Ⅰ中反应在5 min时达到平衡状态。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法中正确的是
A.该反应正反应为放热反应
B.容器Ⅰ中前5 min的平均反应速率υ(CO)=0.16 mol·L-1·min-1
C.容器Ⅱ中,a=0.55 mol
D.若容器Ⅰ为恒压,达到平衡时CO转化率小于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式书写正确的是
A.FeCl3溶液刻蚀铜电路板:Fe3++Cu=Cu2++Fe2+
B.用小苏打治疗胃酸过多:HCO3-+H+= CO2↑+H2O
C.将饱和FeCl3溶液滴入沸水制得Fe(OH)3胶体:Fe3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D.向Ba(OH)2溶液中滴加NaHSO4溶液使Ba2+刚好沉淀完全:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com