
【题目】为探究外界条件对可逆反应:2NO2(g) ![]() 2NO(g) +O2(g) ΔH=- 1162kJ·mol-1的影响,若保持气体的总质量不变,在温度为T1、T2时,通过实验得到平衡体系中 NO体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是( ):
2NO(g) +O2(g) ΔH=- 1162kJ·mol-1的影响,若保持气体的总质量不变,在温度为T1、T2时,通过实验得到平衡体系中 NO体积分数随压强的变化曲线,实验结果如图所示。下列说法正确的是( ):

A. a、c两点混合气体的平均相对分子质量:Ma>Mc
B. b、c两点的平衡常数:Kb=Kc
C. 从状态a到状态c,NO2气体的转化率减小
D. 状态a通过升高温度可变成状态b,a、b两点气体颜色:a深、b浅
【答案】C
【解析】
A.平均相对分子质量![]() ,m总不变。a、c两点所处的环境温度相同,压强不同,P2>P1。从a到c,增大压强,平衡向着气体体积减小的方向移动,即向逆反应方向移动,n总减小。根据公式平
,m总不变。a、c两点所处的环境温度相同,压强不同,P2>P1。从a到c,增大压强,平衡向着气体体积减小的方向移动,即向逆反应方向移动,n总减小。根据公式平![]() ,m总不变,n总减小,可得平均相对分子质量变大,有Ma<Mc,A项错误;
,m总不变,n总减小,可得平均相对分子质量变大,有Ma<Mc,A项错误;
B.b、c两点所处环境的温度不同。温度不同,则平衡常数不同。a和c的温度相同,可以通过a和b的对比,知道T1和T2的大小关系。a、b两点所处的环境温度不同,压强相同,从T1到T2,VNO%增大,反应向正反应方向移动,为放热反应方向,则T1到T2,为降低温度。对于放热反应,降低温度,平衡常数变大,则Kb<Kc;B项错误;
C.从a到c,增大压强,平衡向着气体体积减小的方向移动,即向逆反应方向移动,NO2气体的转化率减小,C项正确;
D.a、b两点所处的环境温度不同,压强相同,从T1到T2,VNO%增大,反应向正反应方向移动,为放热反应方向,则T1到T2,为降低温度。但是状态a到状态b除了升高温度外,还需要保持压强不变。此外状态a和状态b相比较,在状态a下,VNO%较大, NO2较少,颜色比较浅。D项错误;
本题答案选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】有如下转化关系(其他产物及反应所需条件均已略去)。
![]()
以下推断错误的是
A.当X是盐酸时,则F可能是稀硫酸
B.当X是氢氧化钠时,则D是红棕色气体
C.当X是不论是盐酸还是氢氧化钠时,则F都可能是强酸
D.当X是氢氧化钠时,B跟Cl2反应可能有白烟现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3、Cu2O都是红色粉末,常用作颜料。某校化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O溶于稀硫酸生成Cu和CuSO4;在空气中加热生成CuO.
提出假设:
假设1:红色粉末是Fe2O3
假设2:______.
假设3:红色粉末是Cu2O和Fe2O3
(1)设计探究实验:取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN溶液。
(2)若假设1成立,则实验现象是______.
(3)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?______.简述你的理由______.
(4)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明假设______成立
(5)实验小组欲用加热法测定Cu2O的质量分数。取ag固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b>a),则混合物中Cu2O的质量分数为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g) ===2HF(g) ΔH=-270 kJ·mol-1。下列说法正确的是
A. 在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和小于2 mol HF(g)的能量
B. 1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ
C. 该反应的逆反应是放热反应
D. 该反应过程的能量变化可用下图来表示

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对实验的装置、药品、操作和现象的预测中都正确的是( ):
A. 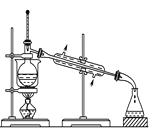 可从含碘的苯溶液里分离出碘单质并回收苯溶剂
可从含碘的苯溶液里分离出碘单质并回收苯溶剂
B. 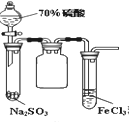 当70%H2SO4跟Na2SO3粉末混合后,可观察到右端试管内出现淡黄色浑浊
当70%H2SO4跟Na2SO3粉末混合后,可观察到右端试管内出现淡黄色浑浊
C. 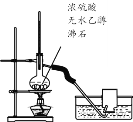 当将烧瓶内液体迅速升温至170℃时,可用排水法收集到乙烯气体
当将烧瓶内液体迅速升温至170℃时,可用排水法收集到乙烯气体
D. 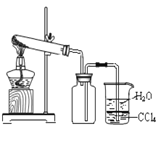 将盛氯化铵和消石灰固体的试管加热,可制取并收集到干燥的NH3
将盛氯化铵和消石灰固体的试管加热,可制取并收集到干燥的NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氟利昂-12(CF2Cl2)是甲烷的氯、氟卤代物,它有2种同分异构体
B.对甲基苯甲醛(![]() )使高锰酸钾酸性溶液褪色,说明它含有醛基
)使高锰酸钾酸性溶液褪色,说明它含有醛基
C.溴水可以区分苯和乙酸
D.糖类是食物组成中的重要部分,也是产生能量最高的营养物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫单质及其化合物性质是一个重要的课题。回答下列问题:
(1)恒容密闭容器中,工业固氮:N2(g)+3H2(g) ![]() 2NH3(g)的平衡常数K值和温度关系如表:
2NH3(g)的平衡常数K值和温度关系如表:
温度/℃ | 25 | 200 | 300 | 400 | 450 |
K | 5108 | 1.0 | 0.86 | 0.507 | 0.152 |
①从上表列出数据分析,该反应为__________反应(填:“吸热”或“放热”)。
②有关工业合成氨的研究成果,曾于1918年、1931年、2007年三次荣膺诺贝尔奖。下列关于关于合成氨反应描述的图像中,不正确的是_________(填:字母选项)。
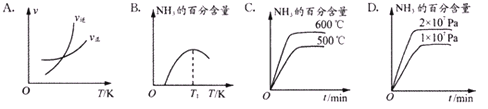
③450℃时,测得某时刻氨气、氮气、氢气物质的量浓度分别为3mol/L、2mol/L、1mol/L时,该反应的v(正)____________v(逆)(填“>”、“=”或“<”)。
(2)近年,科学家又提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH=___________________。(已知:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) △H=-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) △H=-571.6kJ·mol-1 )
2H2O(l) △H=-571.6kJ·mol-1 )
(3)联氨(N2H4)、二氧化氮(NO2)可与KOH溶液构成碱性燃料电池,其电池反应原理为2N2H4 +2NO2 = 3N2+8H2O。则负极的电极反应式为__________________________。
(4)部分金属硫化物的溶度积常数(Ksp)如下表:
硫化物 | CuS | ZnS | MnS | FeS |
Ksp | 6.3×10-36 | 2.9×10-25 | 2.5×10-13 | 6.3×10-18 |
由列表数据分析推知,向含有Cu2+、Zn2+、Mn2+、Fe2+的工业废水中加入MnS粉末的作用是_____________________________________。
(5)工业上从废铅蓄电池废液回收铅的过程中,常用纯碱溶液与处理后的铅膏(主要含PbSO4)发生反应:PbSO4(s)+CO32-(aq)![]() PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
PbCO3(s)+SO42-(aq)。已知溶度积常数:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)=7.4×10-14,则该反应的化学平衡常数K =_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某离子晶体的晶胞示意图如下图所示,其摩尔质量为M g·mol-1,阿伏加德罗常数的值为NA,晶体的密度为d g·cm-3。
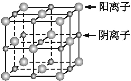
下列说法中正确的是
A. 晶体晶胞中阴、阳离子的个数都为1
B. 晶体中阴、阳离子的配位数都是4
C. 该晶胞可能是NaCl的晶胞
D. 该晶体中两个距离最近的阳离子的核间距为M/d cm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其原理是__________________________________________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1的NH4Al(SO4)2溶液和0.1 mol·L-1NH4HSO4溶液中的c(![]() ),前者_____后者。(填“等于”、“大于”或“小于”)
),前者_____后者。(填“等于”、“大于”或“小于”)
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
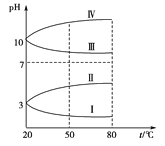
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是_______ (填字母),导致pH随温度变化的原因是__________________;
②20 ℃时,0.1 mol·L-1的NH4Al(SO4)2中2c(SO42-)-c(NH4+)-3c(Al3+)=____________。
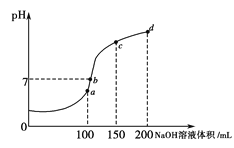
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示。试分析图中a、b、c、d四个点,水的电离程度最大的是___________点;在b点,溶液中各离子浓度由大到小的排列顺序是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com