
【题目】某同学设计如下实验装置用于制取纯净的无水FeCl3.
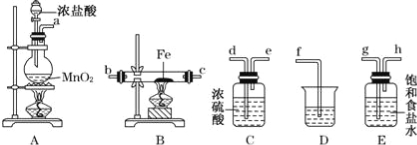
(1)图中盛放浓盐酸的实验仪器的名称为 ,A中发生反应的化学方程式为
(2)各装置的正确连接顺序为:a → → → → → → c → (填字母代号),
(3)装置E的作用是 ,装置C的作用是 。
(4)装置D中所发生反应的离子方程式为 .
(5)装置A中,如果反应产生氯气的体积为2.24L(标准状况),则反应中被氧化的HCl的质量为 ___________。
【答案】(1)分液漏斗;MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)a →g→h→d→e→b→c→f;
(3)除去氯气中的HCl;干燥Cl2;
(4)Cl2+H2O![]() H++Cl-+HClO;(5)7.3g。
H++Cl-+HClO;(5)7.3g。
【解析】
试题分析:该实验目的是用Cl2和Fe反应制取FeCl3 固体,实验室用浓盐酸和MnO2加热制取Cl2,因为要制取纯净干燥的FeCl3,所以生成的Cl2必须是干燥、纯净的,浓盐酸、水都具有挥发性,所以生成的Cl2中含有HCl、H2O,用饱和食盐水除去HCl、用浓硫酸干燥Cl2,氯气有毒,不能直接排空,应该用碱液吸收Cl2。(1)图中盛放浓盐酸的实验仪器的名称为分液漏斗,实验室用浓盐酸和MnO2加热制取Cl2,二者反应生成氯化锰、氯气和水,反应方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;(2)各装置的正确连接顺序为气体制备装置、洗气装置、干燥装置、氯化铁制备装置、尾气处理装置,所以其连接顺序是a→g→h→d→e→b→c→f;(3)装置E的作用是吸收挥发出的HCl,装置C的作用是干燥气体,防止得不到干燥的氯化铁,故答案为:除去氯气中的氯化氢;干燥氯气;(4)装置D中氯气和水反应生成盐酸、次氯酸和水,反应的离子方程式为Cl2+H2O
MnCl2+Cl2↑+2H2O;(2)各装置的正确连接顺序为气体制备装置、洗气装置、干燥装置、氯化铁制备装置、尾气处理装置,所以其连接顺序是a→g→h→d→e→b→c→f;(3)装置E的作用是吸收挥发出的HCl,装置C的作用是干燥气体,防止得不到干燥的氯化铁,故答案为:除去氯气中的氯化氢;干燥氯气;(4)装置D中氯气和水反应生成盐酸、次氯酸和水,反应的离子方程式为Cl2+H2O![]() H++Cl-+HClO;(5)装置A中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量n(Cl2)=2.24L÷22.4L/mol=0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,被氧化HCl的质量是m(HCl)=n·M=0.2mol×36.5g/mol=7.3g。
H++Cl-+HClO;(5)装置A中,如果反应产生氯气的体积为2.24L(标准状况),其物质的量n(Cl2)=2.24L÷22.4L/mol=0.1mol,根据Cl原子守恒计算反应中被氧化的n(HCl)=2n(Cl2)=2×0.1mol=0.2mol,被氧化HCl的质量是m(HCl)=n·M=0.2mol×36.5g/mol=7.3g。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题:
实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备:
已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2∶1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。

(1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150 mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。
A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸
(2)pH小于7会引起Na2S2O3溶液的变质反应,会出现淡黄色浑浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为________________;
实验Ⅱ.产品纯度的检测:
(3)已知:Na2S2O3·5H2O的摩尔质量为248 g/mol;2Na2S2O3+I2=2NaI+Na2S4O6。取晶体样品a g,加水溶解后,滴入几滴淀粉溶液,用0.010 mol/L碘水滴定到终点时,消耗碘水溶液v mL。①滴定终点的现象是 ;②该样品纯度是______________________;
(4)滴定过程中可能造成实验结果偏低的是___________________;
A.锥形瓶未用Na2S2O3溶液润洗
B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数
C.滴定终点时仰视读数
D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡
实验Ⅲ.有毒废水的处理:
(5)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验:
向装有2 mL 0.1 mol/L 的NaCN溶液的试管中滴加2 mL 0.1mol/L 的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10 mL 0.1 mol/L FeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液仅含如表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1 mol。
阳离子 | Na+ Mg2+ Fe3+ Al3+ Fe2+ |
阴离子 | OH- CO |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变。
请推断:
(1)原溶液中含有的阳离子是________; 含有的阴离子是________________。
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以黄铁矿为原料制硫酸产生的硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等。实验室模拟工业以硫酸渣制备铁红(Fe2O3),过程如下:
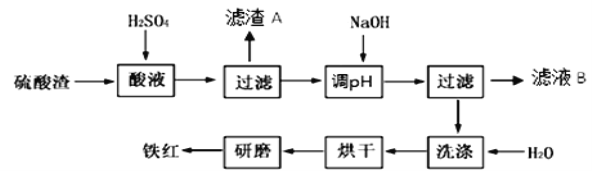
(1)硫酸渣的成分中既能与酸又能与碱反应的是 ,写出酸溶过程Fe2O3与稀硫酸反应的离子反应方程式: 。
(2)生产过程中,为了确保铁红的纯度,氧化过程需要调节溶液的pH的范围是
(部分阳离子以氢氧化物形式沉淀时溶液的pH见下表)
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 |
完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 |
(3)滤渣A的主要成分为 ,滤液B含有的主要物质有 。
(4)如何证明洗涤环节充分洗净 。
(5)已知硫酸渣质量为a kg,假设铁红制备过程中铁元素损耗25%,最终得到铁红的质量为b kg,则原来硫酸渣中铁元素质量分数为 。(用题中所给数据计算并用最简整数比表示结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋是重要的调味品,我国劳动人民在很早以前就知道酒在空气中能“酸败成醋”,该过程的实质是
A、酒中的乙醇挥发,使乙醇的含量降低
B、酒中的乙醇被氧化成乙醛
C、酒中的乙醇被氧化成乙酸
D、酒中的杂质腐败成酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是:
A.在酒精灯加热条件下,Na2CO3、NaHCO3固体都能发生分解
B.Fe(OH)3胶体无色、透明,能发生丁达尔现象
C.H2、SO2、CO2三种气体都可用浓硫酸干燥
D.SiO2既能和氢氧化钠溶液反应有能和氢氟酸反应,所以是两性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com