
����Ŀ��A��B��CΪ������Ԫ�أ������ڱ���������λ����ͼ��ʾ��A��C��Ԫ�ص�ԭ�Ӻ��������֮�͵���Bԭ�ӵĵ�������Bԭ�Ӻ�������������������ȡ�
![]()
(1)д��A��B��C��Ԫ�����ƣ�________��________��________��
(2)C��Ԫ�����ڱ��е�λ����________
(3)B��ԭ�ӽṹʾ��ͼΪ____��C���⻯����B���⻯����ȶ���ǿ��˳��Ϊ___>___���ѧʽ����
(4)�Ƚ�A��C��ԭ�Ӱ뾶��A________������>������<����C��д��A����̬�⻯����A������������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽ��__________��
���𰸡��� �� �� �ڶ����ڢ�A�� ![]() HF H2S > NH3��HNO3=NH4NO3
HF H2S > NH3��HNO3=NH4NO3
��������
����A��ԭ������Ϊx-1����C��ԭ������Ϊx+1��B��ԭ������Ϊx+8���Ӷ��ó�x-1+x+1=x+8��x=8����A��B��C�ֱ�ΪN��S��F����ͬ���ڡ�ͬ����Ԫ�ص����ʵݱ���ɣ��ɱȽ��⻯����ȶ��ԡ�ԭ�Ӱ뾶�Ĺ�ϵ��
(1)�����Ϸ���֪��A��B��C��Ԫ������Ϊ����������������Ϊ����������
(2)CΪ9��Ԫ�ط������ĺ�������Ų�Ϊ2��7����Ԫ�����ڱ��е�λ���ǵڶ�������A�塣��Ϊ���ڶ�������A�壻
(3)BΪ������ԭ������Ϊ16��ԭ�ӽṹʾ��ͼΪ![]() ��CΪ����BΪ�ǽ�����F>S������C���⻯����B���⻯����ȶ���ǿ��˳��ΪHF> H2S����Ϊ��
��CΪ����BΪ�ǽ�����F>S������C���⻯����B���⻯����ȶ���ǿ��˳��ΪHF> H2S����Ϊ��![]() ��HF��H2S��
��HF��H2S��
(4)AΪ����CΪ�������߶�Ϊ�ڶ�����Ԫ�أ���N��F����ߣ�A��C��ԭ�Ӱ뾶��A>C��A����̬�⻯��(NH3���Լ���)��A������������Ӧˮ����(HNO3��������)��Ӧ�Ļ�ѧ����ʽ��NH3��HNO3=NH4NO3����Ϊ��>��NH3��HNO3=NH4NO3��


 ������ȫ�̼����ĩ���100��ϵ�д�
������ȫ�̼����ĩ���100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����״���£�1.92gij��������Ϊ672mL����������Ħ������Ϊ______��
��2��5.4g H2O������ԭ����Ŀ��_____L����״��������������ԭ����Ŀ��ȣ�
��3��A��B��C��D��Ϊ��ѧ��ѧ�ij��������Ҿ�����ͬһ��Ԫ�أ�����֮���ת����ϵ������ʾ����Ӧ���������������Ѿ���ȥ���� A![]() B
B![]() C
C![]() D
D
a.��A��һ�ֽ�����C�ǵ���ɫ���壬д��C��һ����;________��
b.��AΪ����ɫ���嵥�ʣ�ʵ���ҳ����ڼ���B���Լ���__________��
c.��A�ǻ����C�Ǻ���ɫ���壬��D�Ļ�ѧʽΪ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��� A ��δ���������к��е�һ�����ʣ��� C��H��O ����Ԫ����ɣ�A ����̬ʱ���ܶ�����ͬ�����������ܶȵ� 38 ������һ�������� A �ȿ������Ҵ���Ӧ�������ֿ��������ᷴӦ����������֪ 0.1mol A ��ȫȼ��ʱ���� 0.2mol CO2 �� 0.2mol H2O��1mol A ���� 2mol Na �� 1mol NaOH ��Ӧ����ȷ����
(1)�л��� A �ķ���ʽ_________________��
(2)д����Ũ���������£������� A ���Ӧ������Ԫ��״���ʵĻ�ѧ����ʽ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�������ȡ����Ӧ��ʵ��װ��ͼ������AΪ�ɾ���֧�ܵ��Թ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ټ���������м�ۡ�
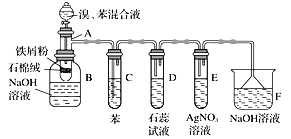
��д���пհף�
(1)��Ӧ����A����μ�����ͱ���������Ӧ��д��A����������Ӧ�Ļ�ѧ����ʽ��___________________________________________________________��
(2)�Թܹ۲�D�п���������Ϊ____________________________________��
(3)����������װ���У����з��������õ�������____________(����ĸ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1������˵����ȷ����___________
A����ѧ��Ӧ��ʵ�ʾ��Ǿɻ�ѧ���Ķ��ѣ��»�ѧ�����γɣ��ڻ�ѧ��Ӧ�У���Ӧ��ת��Ϊ�������ͬʱ����Ȼ�����������ı仯
B���������ⸯʴʱ����������
C�����ȷ�Ӧ����ʱ����һ��Ҫ���ȡ������ȷ�Ӧ����Ҫ���Ȳ��ܷ���
��2���� 101 kPa ʱ��2g H2��ȫȼ������Һ̬ˮ���ų�285��8kJ ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ___________________________��
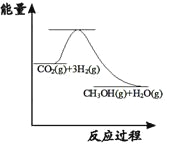
��3��Ŀǰ��ҵ����һ�ַ�������CO2�������״���CO2(g��+3H2(g��![]() CH3OH(g�� +H2O(g����
CH3OH(g�� +H2O(g����
��ͼ��ʾ�÷�Ӧ���й����������ı仯������λΪ��kJ��mol-1���÷�Ӧ��___________��������������������������Ӧ����H__________0����������������������
��4���Ƚ���������Ȼ�ѧ����ʽ����H1����H2����________��
A��2H2(g��+O2(g��=2H2O(g����H1��2H2(g��+O2(g��=2H2O(1����H2
B��S(g��+O2(g��=SO2(g����H1��S(s��+O2(g��=SO2(g����H2
C��C(s��+1/2O2(g��=CO(g����H1��C(s��+O2(g��=CO2(g����H2
D��H2(g��+Cl2(g��=2HCl(g����H1��1/2H2(g��+1/2Cl2(g��=HCl(g����H2
��5��101 kPa�����£�14g N2��3g H2��Ӧ����NH3�������仯����ͼʾ�⣺
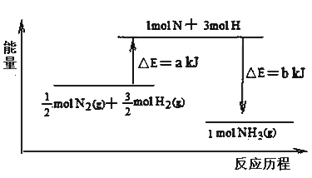
����֪������֪b=1173����25 �桢101 kPa��N2(g��+3H2(g��![]() 2 NH3(g�� ��H =��92 kJ��mol-1��a =_________________��
2 NH3(g�� ��H =��92 kJ��mol-1��a =_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е��뷽��ʽ��д��ȷ����
A. ˮ��Һ��NaHCO3���룺NaHCO3 = Na++H++CO32-
B. H2SO3���룺H2SO3![]() 2H++SO32-
2H++SO32-
C. HClO���룺HClO![]() H++ClO-
H++ClO-
D. ˮ��Һ��NaHSO4���룺NaHSO4 = Na++HSO4-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ 100 mL 1.00 mol/L NaCl ��Һ,����˵����ȷ����( )
A.���������� NaCl ���� 100 mL ˮ��
B.���������� NaCl ��������ˮ�У��ټ�ˮ���ݵ� 100 mL
C.���������� NaCl ֱ�ӷ�������ƿ�У���ˮ���ݵ� 100 mL
D.����ʱ���Ӷ��̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Լ����CO2�ĸ�Ч���ò����ܻ��������ů�����Ҷ�����ݽߵ�ʯ����ԴҲ��һ���IJ������ã������������CO2������Ӧ�У�
��Ӧ��i����2CH4(g)��O2(g)![]() 2CO(g)��4H2(g)�� ��H=��71.4kJmol-1
2CO(g)��4H2(g)�� ��H=��71.4kJmol-1
��Ӧ��ii����CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��H=+247.0 kJmol-1
2CO(g)��2H2(g) ��H=+247.0 kJmol-1
��1��д����ʾCOȼ���ȵ��Ȼ�ѧ����ʽ��_______________________________��
��2�������������Ϊ2L�ĺ����ܱ������У���ʼʱ��������Ӧ�����������ʣ�����ͬ�¶��½��з�Ӧ��ii����CH4(g)��CO2(g)![]() 2CO(g)��2H2(g) ��������������Ӧ����CO2��ƽ��ת�������±���ʾ��
2CO(g)��2H2(g) ��������������Ӧ����CO2��ƽ��ת�������±���ʾ��
���� | ��ʼ���ʵ���(n) / mol | CO2�� ƽ��ת���� | |||
CH4 | CO2 | CO | H2 | ||
�� | 0.1 | 0.1 | 0 | 0 | 50�� |
�� | 0.1 | 0.1 | 0.2 | 0.2 | / |
��������˵����Ӧ�ﵽƽ��״̬��_________��
A��v��(CH4) =2v��(CO)
B�������ڸ����ʵ�Ũ������c(CH4)��c(CO2)=c2(CO)��c2(H2)
C�������ڻ���������ѹǿ���ٱ仯
D�������ڻ�������ܶȱ��ֲ���
�����������ڷ�Ӧ�ӿ�ʼ��ƽ�����õ�ʱ��Ϊt min����t min�ڸ÷�Ӧ��ƽ����Ӧ����Ϊ��v(H2) = ________���ú�t�ı���ʽ��ʾ����
���ﵽƽ��ʱ��������������CO�����ʵ����Ĺ�ϵ���㣺2n(CO)��_______n(CO)������������������������������
��3����CH4(g)��O2(g)�����ʵ�����Ϊ4:3����ʢ�д����ĺ����ܱ������ڣ�����������Ӧ��i����2CH4(g)��O2(g)![]() 2CO(g)��4H2(g)����ͬʱ����ڲ��CO���������[��(CO)]���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
2CO(g)��4H2(g)����ͬʱ����ڲ��CO���������[��(CO)]���¶ȣ�T���Ĺ�ϵ��ͼ��ʾ��
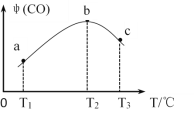
�� T2��ʱ��CO�����������ԭ����_____________��
����T2��ʱ����������ʼѹǿΪP0��ƽ��ʱCO���������Ϊ20������Ӧ��ƽ�ⳣ��KP =_______����ƽ���ѹǿ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�����������
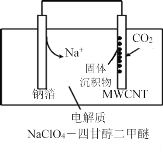
��4��2016���ҹ�������Ա���ݷ�ӦNa+CO2�� Na2CO3+C��δ��ƽ�� ���Ƴ�һ���������ɺ�����Na-CO2��ء��ŵ�ʱ�õ����������CO2�����ʱ��������CO2����ŵ�ʱ�Ĺ���ԭ����ͼ��ʾ����֪���յ�ȫ��CO2�У���![]() ת��ΪNa2CO3��������ڶ��̼���ܣ�MWCNT���缫���棬д���ŵ�ʱ�����ĵ缫��Ӧʽ��_________________��
ת��ΪNa2CO3��������ڶ��̼���ܣ�MWCNT���缫���棬д���ŵ�ʱ�����ĵ缫��Ӧʽ��_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰһ����ɢϵ�������ص����һ�ַ�ɢϵ���۲쵽���������ȳ�����������ǣ� ��
A.�������������еμ�����
B.���ǻ�����������Һ�м�����
C.�Ȼ�����Һ�еμ��ռ���Һ
D.�Ȼ�����Һ�еμӰ�ˮ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com