
【题目】高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂。

(1)工业上的湿法制备方法是用KClO与Fe(OH)3在KOH存在下制得K2FeO4,该反应氧化剂与还原剂物质的量之比为________________。
(2)实验室用食盐、废铁屑、硫酸、KOH等为原料,通过以下过程制备K2FeO4:
①操作(Ⅰ)的方法为_________________,隔绝空气减压干燥。
②检验产生X气体的方法是________________。
③最终在溶液中得到K2FeO4晶体利用的原理是____________________。
(3)测定某K2FeO4样品的质量分数,实验步骤如下:
步骤1:准确称量1.0g样品,配制100mL溶液,
步骤2:准确量取25.00mL K2FeO4溶液加入到锥形瓶中
步骤3:在强碱性溶液中,用过量CrO2-与FeO42-反应生成Fe(OH)3和CrO42-
步骤4:加稀硫酸,使CrO42-转化为Cr2O72-,CrO2-转化为Cr3+,Fe(OH)3转化为Fe3+
步骤5:加入二苯胺磺酸钠作指示剂,用0.1000mol·L-1(NH4)2Fe(SO4)2标准溶液滴定至终点(溶液显紫红色),记下消耗(NH4)2Fe(SO4)2溶液的体积,做3次平行实验,平均消耗(NH4)2Fe(SO4)2溶液的体积30.00 mL。
已知:滴定时发生的反应为:6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①步骤2中准确量取25.00mL K2FeO4溶液加入到锥形瓶中所用的仪器是______________。
②写出步骤3中发生反应的离子方程式__________________________。
③步骤5中能否不加指示剂_________,原因是________________。
④根据上述实验数据,测定该样品中K2FeO4的质量分数为__________。
(4)配制0.1mol·L-1的K2FeO4,调节溶液pH,含铁离子在水溶液中的存在形态如图所示。下列说法正确的是__________ (填字母)。

A.pH=2时,c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1
B.向pH=10的这种溶液中加硫酸铵,则HFeO4-的分布分数逐渐增大
C.向pH=1的溶液中加HI溶液,发生反应的离子方程式为:H2FeO4+H+=H3FeO4+
D.将K2FeO4晶体溶于水,水溶液呈弱碱性
【答案】 3:2 蒸发浓缩、冷却结晶、过滤、洗涤 用带火星的木条接触气体 K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小 酸式滴定管 CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH- 否,因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显 0.792(或79.2%) A D
【解析】(1)本题考查氧化还原反应得失电子守恒,根据得失电子数目守恒,即n(KClO)×2=n[Fe(OH)3]×3,n(KClO):n[Fe(OH)3]=3:2;(2)本题考查物质的制备,①从FeSO4溶液中得到FeSO4固体,操作I的方法是蒸发浓缩、冷却结晶、过滤、洗涤得到FeSO4;②发生反应是2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑,气体X为O2,用带火星的木条接触气体,如果带火星的木条复燃,说明是氧气;③利用K2FeO4在0℃时的溶解度比Na2FeO4、NaOH、KOH、Na2SO4小;(3)本题考查滴定实验,①K2FeO4具有氧化性,能腐蚀橡胶,因此不能用带橡胶的碱式滴定管,步骤2中准确量取25.00mLK2FeO4溶液加入到锥形瓶中,所用的仪器应是酸式滴定管;②步骤3中发生反应是CrO2-+FeO42-→Fe(OH)3↓+CrO42-,Cr的化合价由+3价→+6价,化合价升高3价,Fe的化合价由+6价→+3价,化合价降低3价,最小公倍数为3,根据原子守恒和电荷守恒,配平其他,即离子反应方程式为:CrO2-+FeO42-+2H2O=Fe(OH)3↓+CrO42-+OH-;③因为K2Cr2O7溶液为橙色、Fe3+的溶液为黄色,颜色变化不明显,因此需要加指示剂;④根据反应方程式,建立关系式:6(NH4)2Fe(SO4)2~Cr2O72-~2CrO2-~2FeO42-,n(K2FeO4)=n[(NH4)2Fe(SO4)2]/3=30×10-3×0.1/3mol=0.001mol,K2FeO4的质量为0.001×198g=0.198g,其质量分数为0.198×4/1×100%=79.2%;(4)本题考查物料守恒等知识,A、由图中曲线可知,溶液pH=2时,不存在FeO42-,因此有c(H3FeO4+)+c(H2FeO4)+c(HFeO4-)=0.1mol·L-1,故正确;B、向pH=10的溶液中加硫酸铵,溶液的pH逐渐减小,HFeO4-的分布分数逐渐增大,若加入硫酸铵较多,溶液酸性较强,则HFeO4-的分布分数先增大后逐渐减小,故错误;C、向pH=1的溶液中加HI溶液,HI具有还原性,H2FeO4有氧化性,发生氧化还原反应,故错误;D、pH=7时,HFeO4-和FeO42-共存,将K2FeO4晶体溶于水,FeO42-水解成HFeO4-,因此水溶液显碱性,故正确。


 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
【题目】下列关于物质的用途的说法不正确的是( )
A. SO2可用于漂白纸浆 B. 氢氧化铝、碳酸氢钠可用于治疗胃酸过多
C. 钢罐可用于储运浓硫酸 D. 磁性氧化铁可用于制备红色颜料和油漆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)③的元素符号是____________,⑧的元素名称是____________。①在元素周期表中的位置是(周期、族)______________。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_______________;名称是____________;碱性最强的化合物的电子式是:_______________________________; 属何类化合物(指离子化合物或共价化合物)_______________________。
(3)比较④和⑦的氢化物的稳定性____________________
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式__________________。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式 ______________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4为二元弱酸。20℃配制一组c(H2C2O4)+c(HC2O4–)+c(C2O42–)=0.100 mol·L–1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。一定正确的是
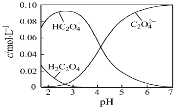
A.pH=2.5的溶液中:c(H2C2O4)+c(C2O42–)>c(HC2O4–)
B.c(Na+)=0.100 mol·L–1的溶液中:c(H+)+c(H2C2O4)=c(OH–)+c(C2O42–)
C.c(HC2O4–)=c(C2O42–)的溶液中:c(Na+)>0.100 mol·L–1+c(HC2O4–)
D.pH=7的溶液中:c(Na+)<2c(C2O42–)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原子的一种激发态为1s22s12p1,则该元素在周期表中的位置为
A. 第二周期ⅡA族 B. 第二周期ⅢA族
C. 第二周期ⅠA族 D. 第二周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池与现代人的生活密切相关,某同学为了研究原电池原理设计了如图所示的装置。下列说法错误的是

A. X、Y不用导线连接时,铜棒上会有银析出
B. X和Y用导线连接时,银棒上发生的电极反应为Ag++e-==Ag
C. X和Y用导线连接时,电子由银经导线移向铜,再经电解质溶液移向银
D. 无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F可用于制造香精,可利用下列路线合成。

回答下列问题:
(1)![]() 分子中可能共面的原子最多有_____个;
分子中可能共面的原子最多有_____个;
(2)物质A的名称是______;
(3)物质D中含氧官能团的名称是_______;
(4)“反应④”的反应类型是______;
(5)写出“反应⑥”的化学方程式:________;
(6)C有多种同分异构体,与C中所含有的官能团相同的有_____种,其中核磁共振氢谱为四组峰的结构简式为 和_______。
和_______。
(7)参照上述合成路线,以 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线:_______________。
的合成路线:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐易[(NH4)2Fe(SO4)2]易溶于水,具有还原性。以下是利用废铁屑、稀硫酸和硫酸铵为原料制取摩尔盐的流程图。

回答下列问题:
(1)在“步骤l”中加Na2CO3溶液是为了洗涤除去废铁屑表面的油污,加热的目的是______(利用简要文字和必要的离子方程式说明),配制100g10%的Na2CO3溶液需要的仪器有药匙、量筒、烧杯、玻璃棒和_______;
(2)“步骤2”中所用废铁屑必须过量,原因是______________;
(3)“步骤3”加入(NH4)2SO4固体充分搅拌溶解后,依次进行的实验操作是:蒸发浓缩、______、过滤、洗涤、干燥;
(4)一般采用滴定法测定摩尔盐产品中Fe2+的含量:称取4.0g摩尔盐样品,溶于水,加入适量稀硫酸,用0.2 mol/LKMnO4溶液滴定,达到终点时,消耗10.00 mL KMnO4溶液。
① 滴定过程中发生反应的离子方程式为___________;
② 产品中Fe2+的质量分数为_________;
③ 滴定过程中.左手控制________,右手摇动锥形瓶,直到_________时停止滴定,读数。此时若俯视读数.测定结果将偏________(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,在科学上没有错误的是
A. 吸带过滤嘴的香烟,对人体无害
B. 保护环境就是保护人类自己
C. 纯天然物质配成的饮料,不含任何化学物质
D. 水可以变为油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com