
| A、F--→HF |
| B、HCl-→Cl2 |
| C、CO32--→CO2↑ |
| D、ClO3--→Cl2 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
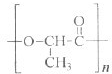
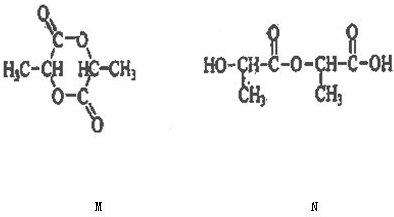
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.012kg 12C含有的12C是NA个 |
| B、NA个水分子的质量是18g/mol |
| C、1mol O2中含有的氧气分子数为NA个 |
| D、含有NA个氧原子的H2SO4的物质的量是0.25mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在氧化还原反应中,一种元素被氧化的同时一定有另一种元素被还原 |
| B、在101KPa下,1mol物质完全燃烧的反应热叫做该物质的热值 |
| C、在化合物中,不是电解质就是非电解质 |
| D、对于可逆反应,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com